天游线路检测中心 使用气相色谱飞行时间质谱 (GC-TOFMS) 对清酒中的代谢物进行非靶向分析
MS 提示第 467 号
简介
清酒是一种传统的日本清酒,其主要成分是大米、米曲和水。除酒精外,清酒还含有氨基酸、有机酸和糖等成分,这些成分会产生各种风味和味道。此外,根据大米的抛光率和是否添加酿造酒精,清酒分为特定清酒类型(吟酿清酒、纯米清酒、本酿造清酒)和普通清酒等其他类型。1)清酒中的氨基酸、有机酸和糖等成分被认为源自清酒中微生物(麦芽、酵母)的代谢,因此有可能通过代谢组分析对这些类型的清酒进行分类。
气相色谱-质谱仪 (GC-MS) 因其丰富的文库数据库 (DB)、易于操作和测量重复性高而被广泛用于代谢组分析。尽管GC-MS针对的是高挥发性成分,但通过进行TMS转换等衍生化处理,也可以测量高极性水溶性代谢物,例如糖和氨基酸。另外,在代谢组学领域,可能会检测到未在库DB中注册的“未知物质”。在这种情况下,通过使用飞行时间质量计(TOFMS)作为质谱仪并进行结合了电子电离和软电离方法的“综合分析”,甚至可以确定未知物质的分子式。2)此外,一种综合结构分析方法,结合了使用深度学习的质谱预测3)配备的“未知物质自动结构分析软件msFineAnalysis AI”(以下称为AI结构分析),可以推定结构式。因此,在本 MSTips 中,我们将介绍一个使用气相色谱飞行时间质谱 (GC-TOFMS) 对清酒中代谢物进行非靶向分析的示例。
实验
衍生化过程
对于样品,我们使用了四种不同类别的市售清酒(大吟酿清酒、纯米清酒、本酿造清酒和黑酒)。将 Nigori 清酒离心(4°C,10 分钟,12,000 rpm),仅将上清液用于实验。我们还准备了质量检查 (QC) 样品,其中所有样品等量混合。图1显示了样品衍生化工艺流程。向各样品 20 µL 中添加 10 µL 1 mg/mL 芥子酸甲醇溶液作为内标,混合后,在蒸发器中干燥,然后在干燥器中放置过夜。第二天,将 100 µL 20 mg/mL 盐酸甲氧胺吡啶溶液添加到每个样品容器中,并将样品在恒温摇床中加热并摇动(30°C,90 分钟,1200 rpm)。之后,添加50μL N-甲基-N-(三甲基甲硅烷基)三氟乙酰胺(MSTFA),并将混合物在热振荡器中再次加热并摇动(37℃,30分钟,1200rpm)。
GC-MS 测量
测定中使用气相色谱飞行时间质谱仪JMS-T2000GC AccuTOF TM GC-Alpha(日本电子株式会社制造)。离子源使用EI/FI/FD共用离子源,软电离方法使用EI法和场电离(FI)法。对于每个样品,使用 EI 方法进行 n=3 次测量,使用 FI 方法进行 n=1 次测量。其他详细条件如表1所示。
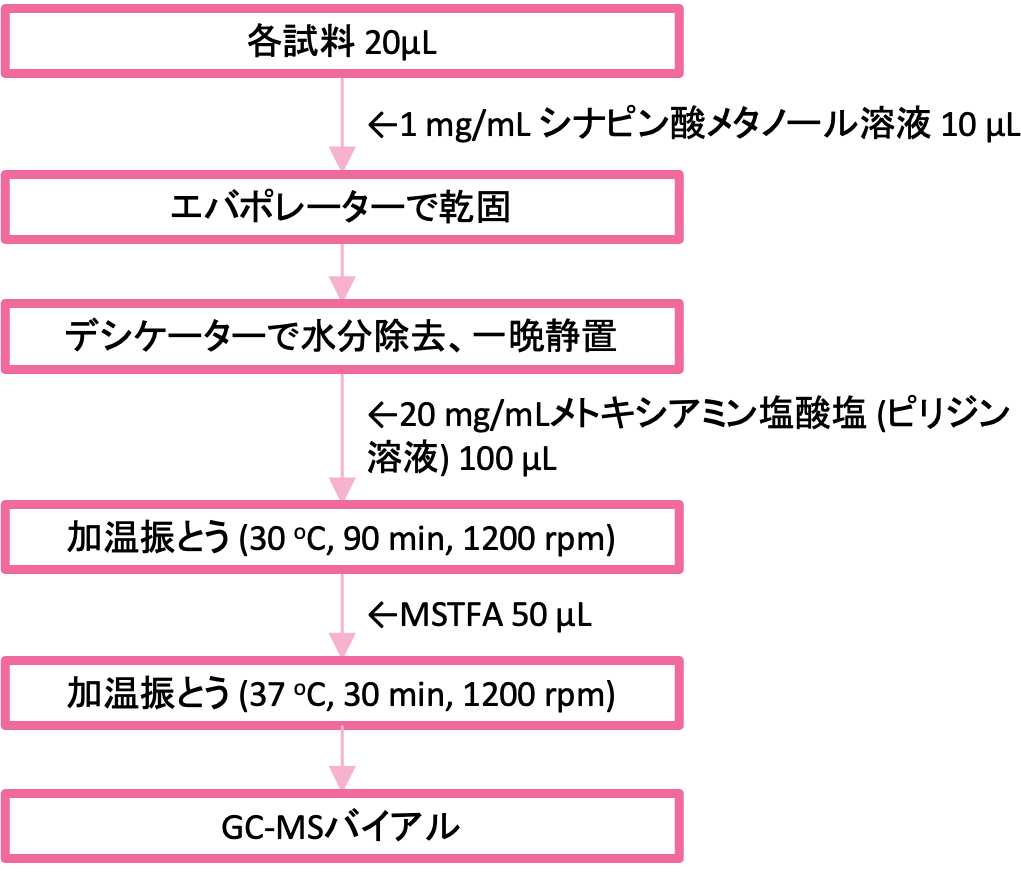
图1衍生化流程
数据分析
使用 JMS-T2000GC 的控制软件 msAxel 将测量中获得的 EI 方法数据转换为 netCDF(GC-MS 的通用数据格式)。该数据应用于代谢组学分析程序 MS-DIAL(版本 49,RIKEN)进行峰检测和化合物鉴定。在鉴定化合物时,我们使用了msFineAnalysis AI(天游线路检测中心制造),它可以整合和分析EI和FI方法的数据,以更高的准确度识别峰并防止错误识别。化合物鉴定后,使用内标物质和LOWESS法进行峰归一化,导出各成分的峰高。然后是MetaboAnalyst 604)在多变量分析过程中,使用 AutoScaling 进行归一化后,进行主成分分析和层次聚类分析。
表1 GC-MS测量条件
| GC | |
|---|---|
| 列 | HP-5MS 用户界面(安捷伦)30 m×025 mm内径,df=025 µm |
| 入口 | 250°C,用于多变量分析:拆分 50:1,用于化合物鉴定:拆分 5:1 |
| 烤箱 | 80°C(2 分钟)→ 15°C/分钟 → 325°C/分钟(7 分钟) |
| 载流 | He,10 mL/min(恒流) |
| MS | |
|---|---|
| 离子源 | EI/FI/FD 组合离子源 |
| 电离 | EI+:70 eV,300 μA,FI+:-10 kV,10 mA |
| m/z范围 | 用于多变量分析:m/z 33 - 800用于化合物鉴定:m/z33 - 1600 |
结果与讨论
TICC 比较结果
图2为本次采集数据的EI法TICC。每个样品中都检测到了许多清酒特有的成分,包括甘油和甘油葡萄糖苷等糖醇、葡萄糖、氨基酸和有机酸。由于各样品中各成分的峰强度不同,因此使用多变量分析进行详细分析。
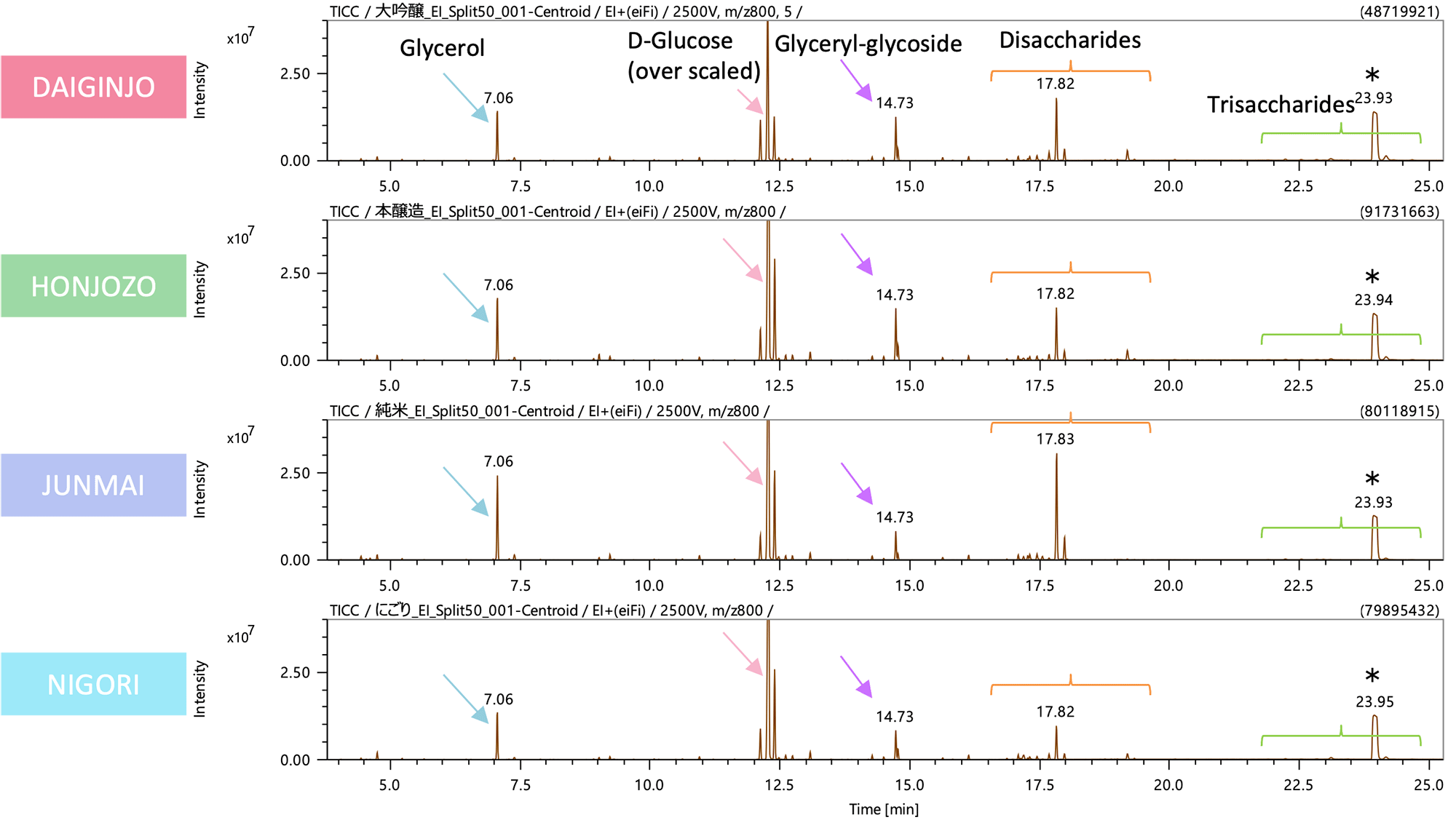
*:外部m/z校准剂
图 2 清酒中代谢物的 TICC
主成分分析
图 3 显示了使用 MetaboAnalyst 对使用内标和 LOWESS 方法标准化的数据进行主成分分析 (PCA) 的结果。从图 3-A 中的得分图中,可以根据第一主成分 (PC1) 的正分和负分对大吟酿清酒、本酿造清酒、Nigori 清酒和纯米清酒进行分类。据推测,这表明了清酒生产过程中是否添加酿造酒精的差异。此外,还可以根据第二主成分(PC2)的正分和负分对大吟酿清酒、本酿造清酒、浊清酒和纯米清酒进行分类。推测这是由于用作原料的大米的碾磨率不同造成的。虽然黑酒没有指定具体名称清酒的分类,但该结果表明它与本酿造酒附近绘制,因此认为两者具有相似的特征。
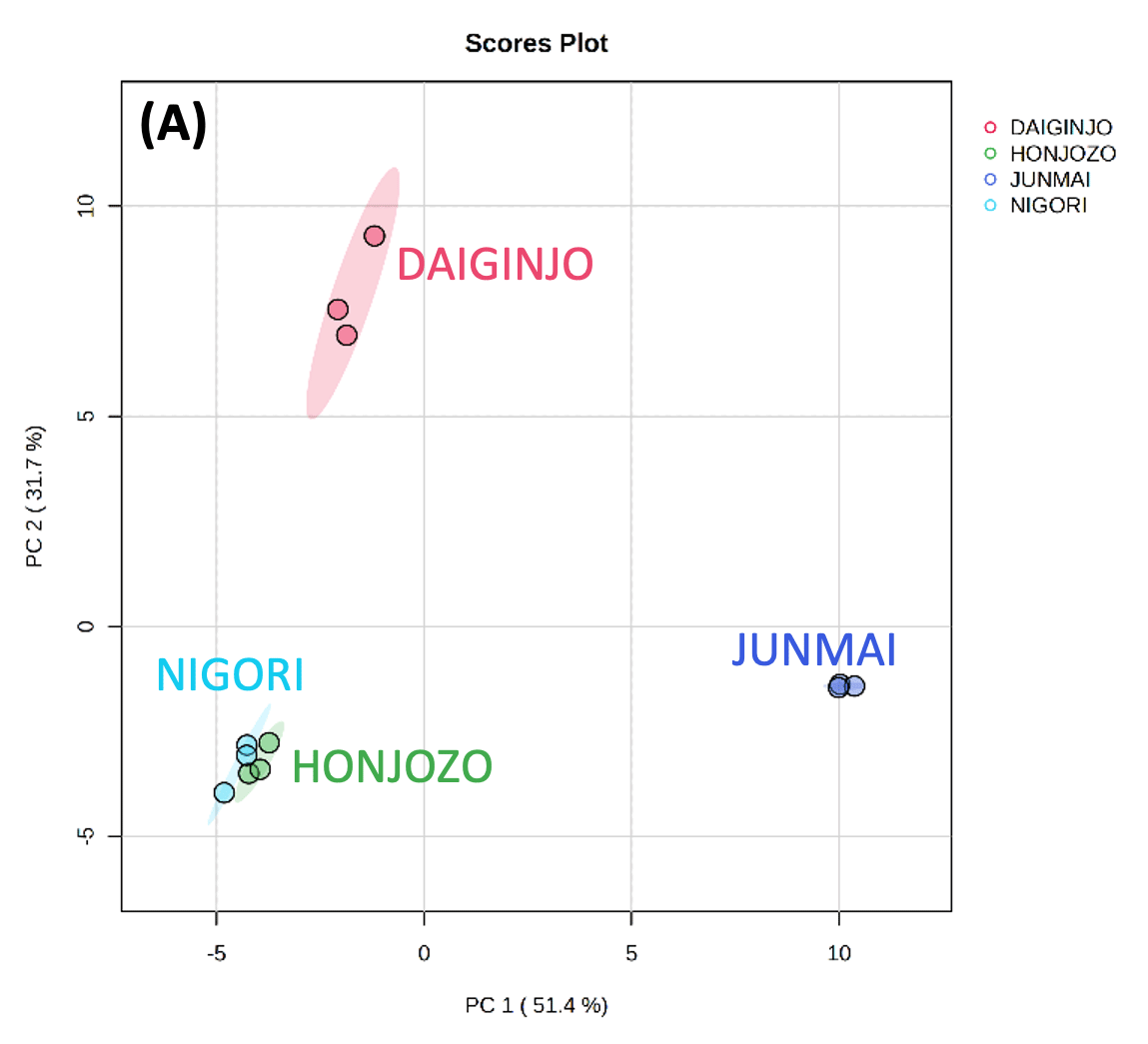
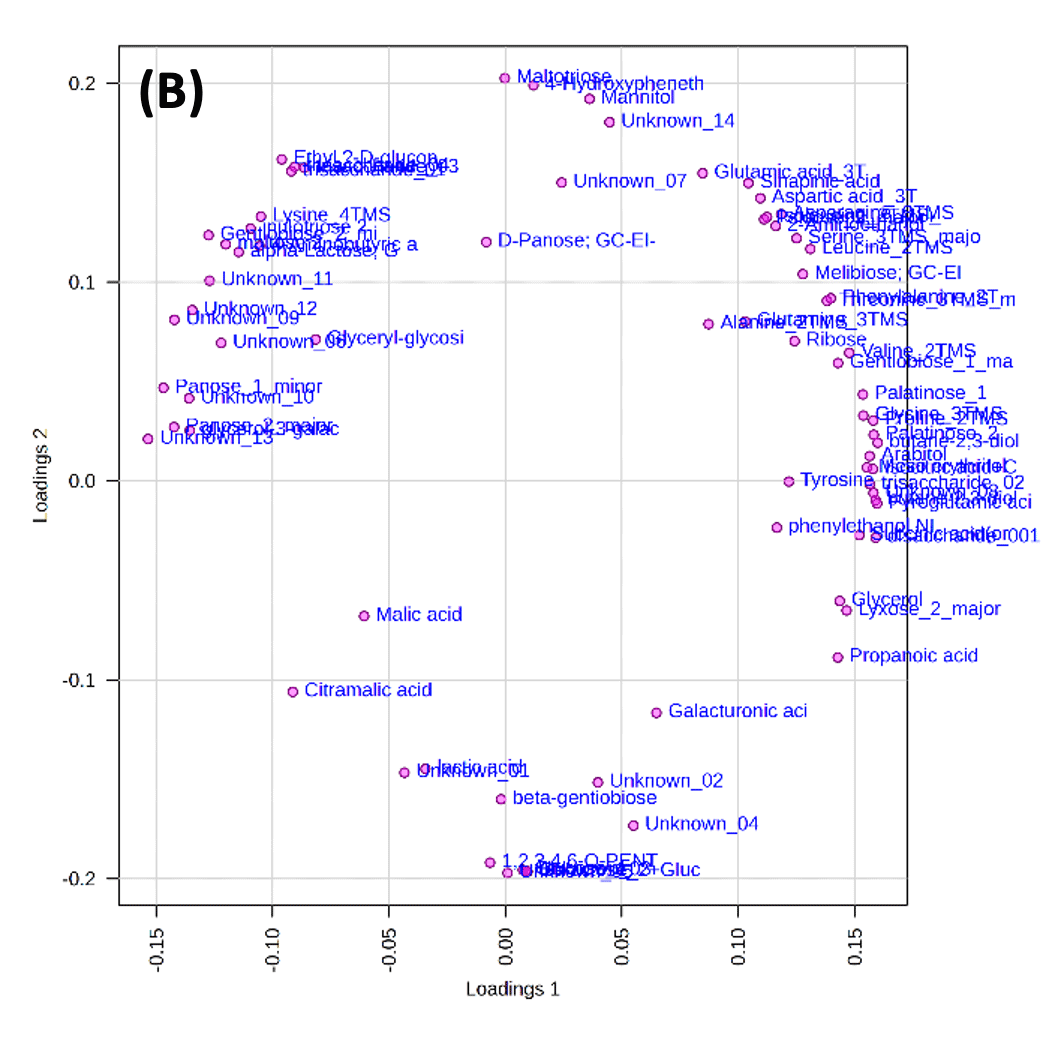
图3 主成分分析结果(A) 得分图,(B) 加载图
层次聚类分析
5)由于纯米酒仅使用大米、曲子和水制成,不添加酿造酒精,因此一般认为其具有凸显大米鲜味和浓郁的风味。上述成分可能与本次测定的纯麦酒独特的口味有关。
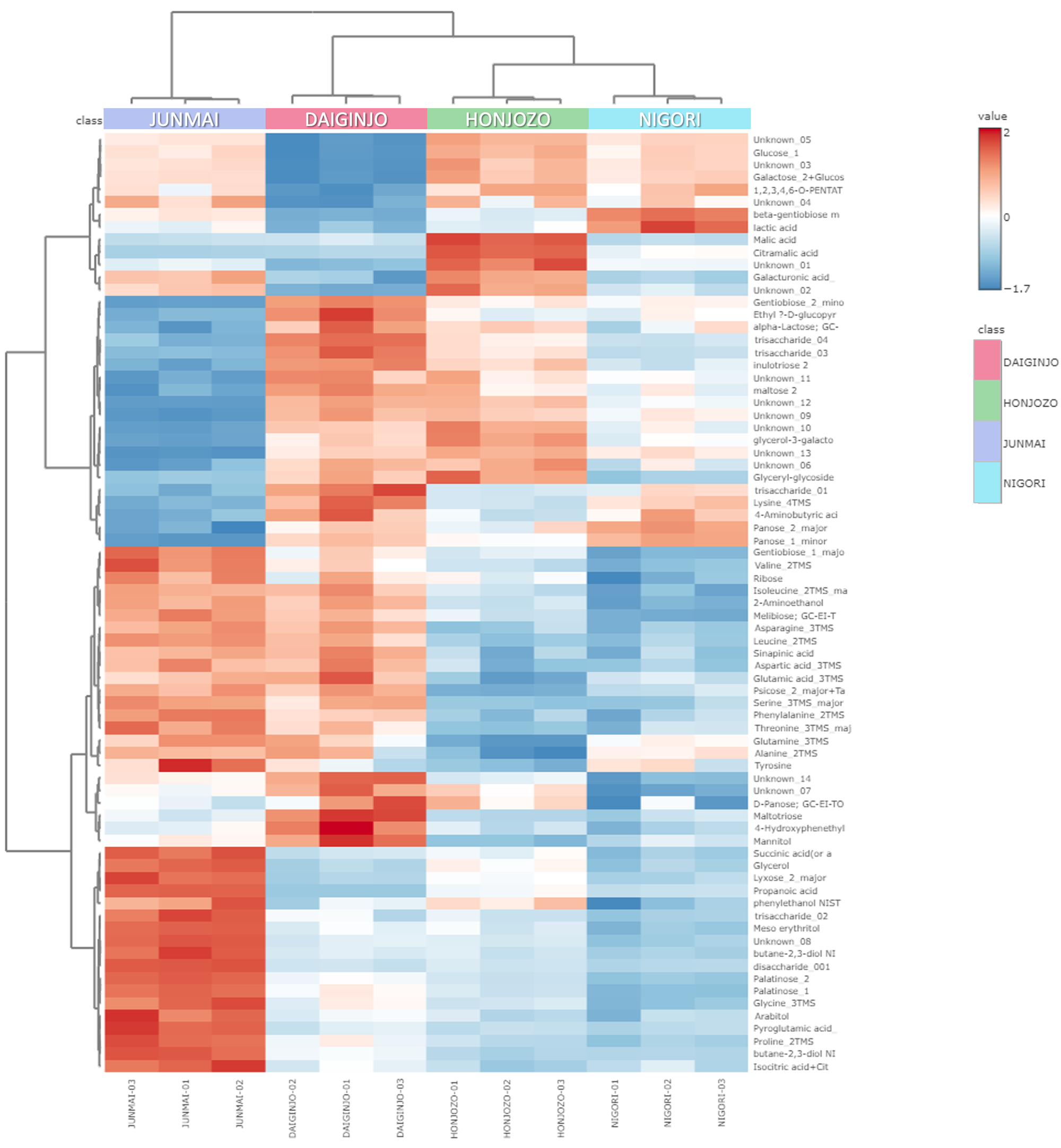
图 4 层次聚类分析 (HCA) 结果
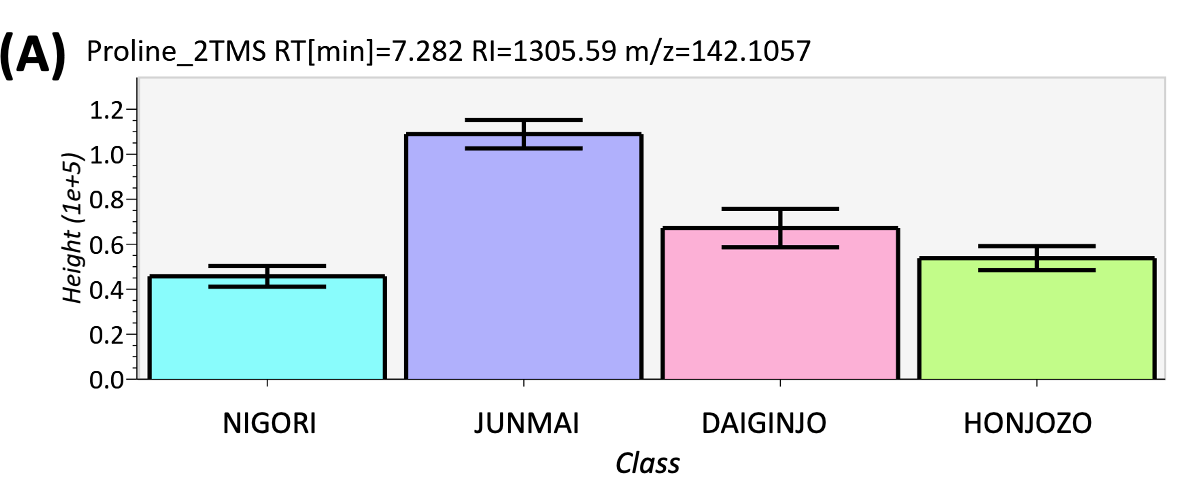
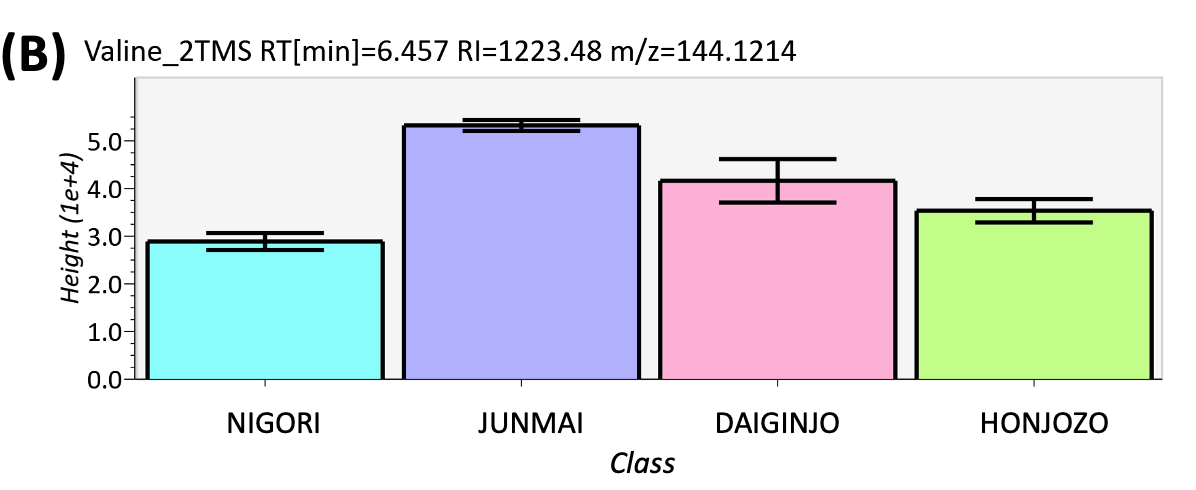
图5 峰强度比较结果(A) 脯氨酸,(B) 缬氨酸
未在库 DB 中注册的化合物的定性分析
在这次检测到的组件中,还检测到了一些被认为尚未在库DB中注册的组件。作为示例,下面描述了一种组分的综合分析和结构估计结果(图 2 中 RT 1782 分钟处的峰值)。图 6 显示了本酿造清酒中该成分的质谱图。该成分仅在FI法的质谱中被推测为分子离子,该法是软电离法m/z947,EI法未检测到相应的离子。通过FI法对检测到的分子离子的元素组成进行推定,该成分的分子式为C37H89否11硅8尽管推测该分子式源自具有还原性的二糖的肟和TMS衍生化,但保留指数值为Δ169,与具有匹配分子式且在文库检索中首次命中的化合物(β-龙胆二糖、八(三甲基硅基)醚、甲基肟(异构体1))显着不同(表2)。因此,该组分的分子式为C37H89否11硅8,但实际上估计是库DB中未注册的组件。图7显示了该组件的AI结构分析结果。第一个候选物是二糖的异麦芽酮糖衍生物。由于异麦芽酮糖衍生物尚未在 NIST 库中注册,因此该成分有可能是异麦芽酮糖。
即使对于使用 EI 方法的代谢组学分析难以分析的高质量组分,我们也能够使用 FI 方法清晰地检测分子离子。此外,即使未在库DB中注册,也可以推断结构式。
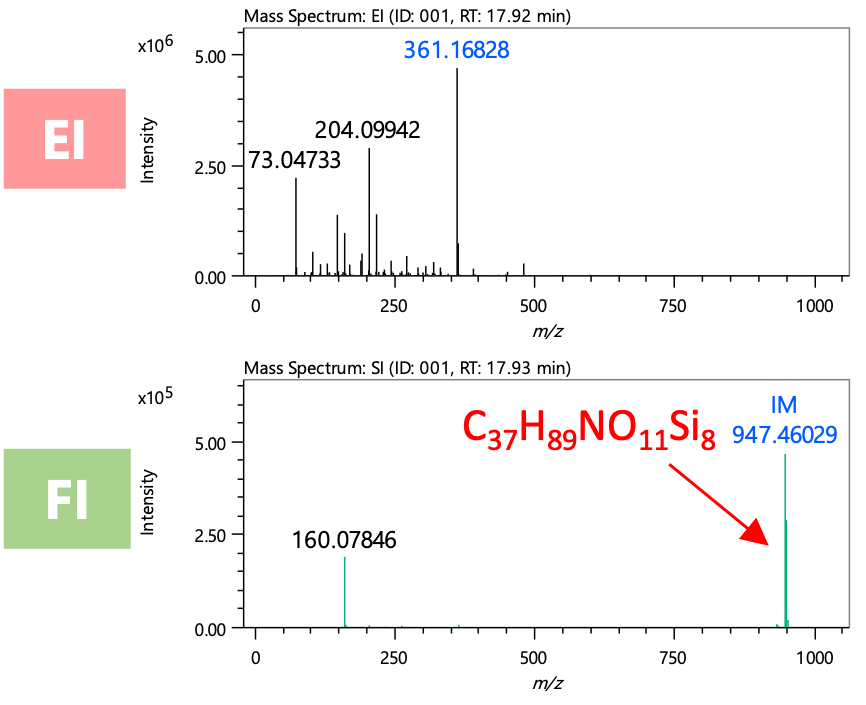
图6 未知化合物的质谱
表2 未知化合物综合定性分析结果
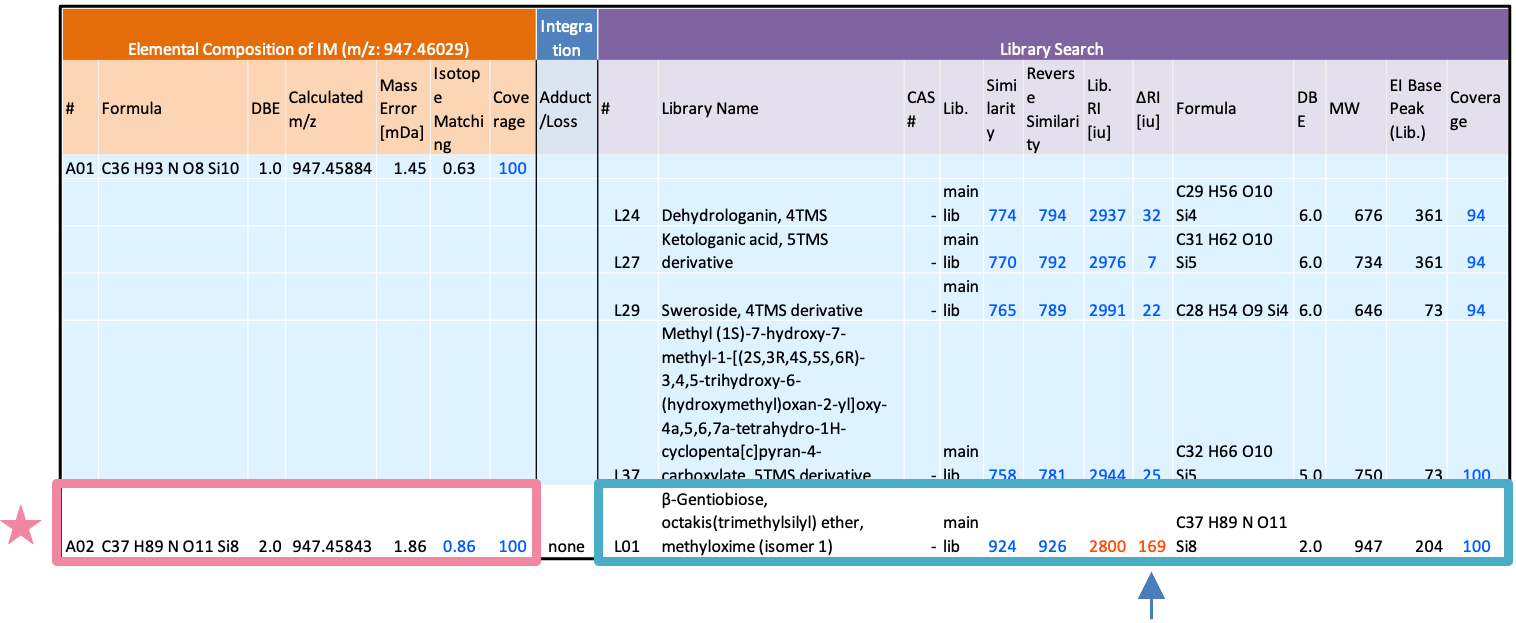
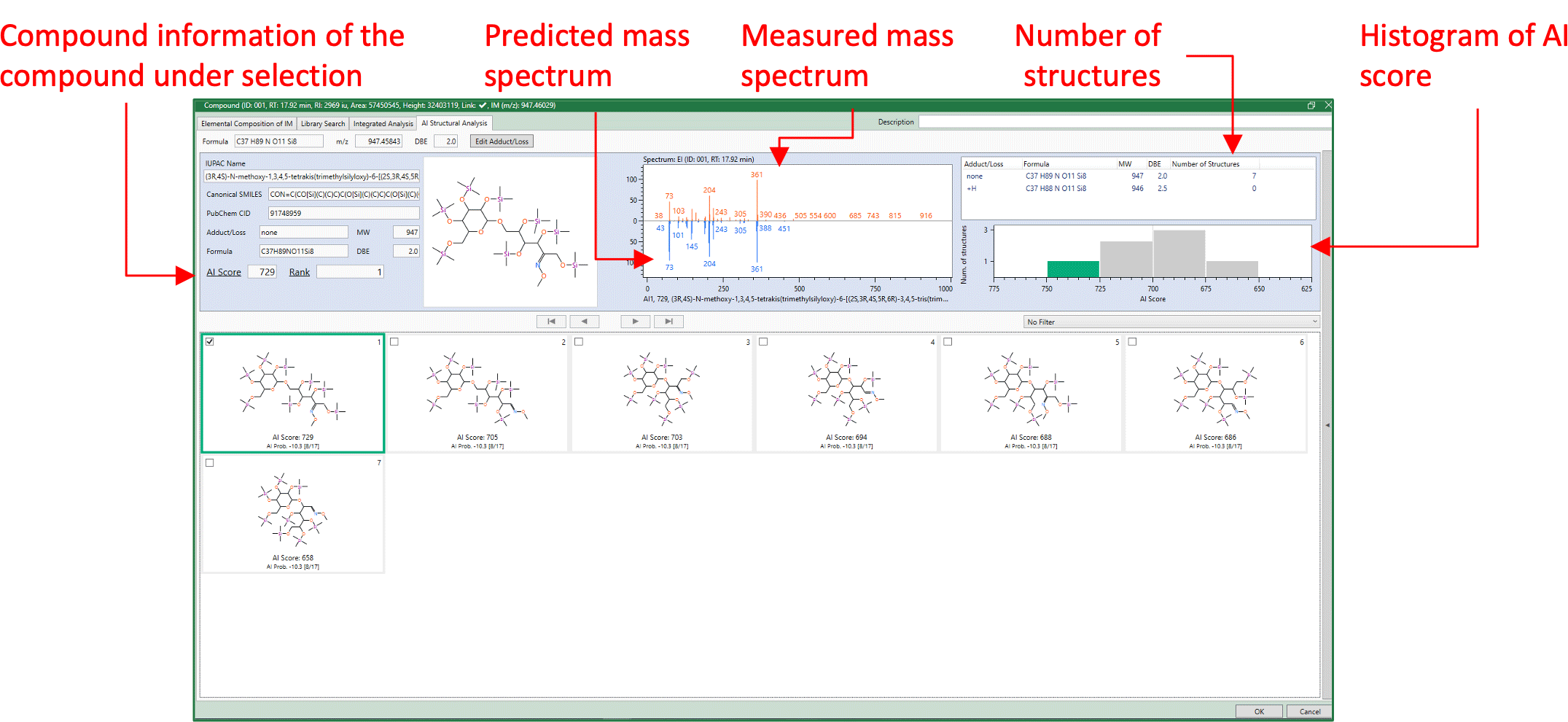
图7 未知化合物AI结构分析结果
结论
在此 MSTips 中,我们介绍了使用 GC-TOFMS 对日本清酒中代谢物进行非靶向分析的示例。即使是使用传统 GC-MS 测量难以测量的高极性代谢物也可以通过 TMS 衍生化轻松测量。此外,通过进行多变量分析,我们能够按类型对清酒进行分类。此外,即使对于由于分子量大而难以通过GC-QMS测量的二糖的TMS衍生物,我们也能够使用GC-TOFMS和FI方法测量分子离子。即使对于未在库中注册的化合物,也可以使用未知物质结构分析软件msFineAnalysis AI来估计其结构式。已证实 GC-TOFMS 和 msFineAnalysis AI 在使用 GC-MS 的代谢组学领域是有效的。
参考文献
- 国家税务局。 2023“清酒制造方法质量显示标准”概述。https://wwwntagojp/taxes/sake/hyoji/seishu/gaiyo/02htm.
- M。 Ubukata 等人,Rapid Commun Mass Spectrom。 2020; 34:e8820。
- A kubo 等人,质谱,2023, 12, A0120。
- 代谢分析器 60。https://metaboanalystca/
- 小川春夫。日本清酒的成分和风味。气味和气味环境学会杂志,卷。 46,第 5 期,2015 年。


