天游线路检测中心 wPMLG 方法的高分辨率11H固态NMR实验条件设置及处理流程
NM200010
1H是一种核素,由于其接近100%的高自然丰度比和高旋磁比而给出最灵敏的NMR信号,并且是一种溶液1H NMR是有机化合物结构分析不可缺少的重要分析方法。另一方面,在固态核磁共振中,这些特征是1H 之间创建了一个强大的偶极子耦合网络,从而在静止条件下产生了超过 50 kHz 的极宽频谱(图 1a)。魔角旋转 (MAS)1H偶极子相互作用的一阶项,但典型的MAS频率(~20kHz)不足以获得高分辨率频谱(图1b)。高分辨率固体1为了获得H谱,需要消除这种偶极子耦合,通常使用CRAMPS方法(组合旋转和多脉冲光谱),该方法结合了MAS方法和通过RF脉冲旋转磁化强度的多脉冲方法。此外,随着MAS技术的最新发展,超过100kHz的超高速MAS探头已经被开发出来,现在可以单独使用MAS获得高分辨率光谱(图1c)。超快 MAS 非常有吸引力,因为它可以进行高灵敏度测量,并且易于测量和处理,但传统的 CRAMPS 方法不需要超快 MAS 探头等特殊设备,仍然有用,并且在分辨率方面通常比超快 MAS 更好。在本应用笔记中,我们将重点关注使用 wPMLG(窗口相位调制 Lee-Goldburg)的高分辨率,它是使用最广泛的 CRAMPS。1H固态NMR谱的过程。
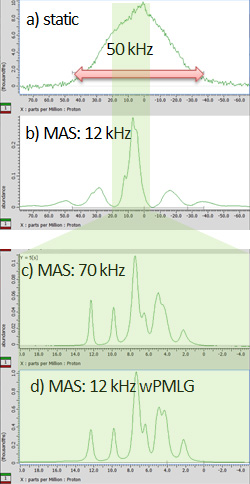
图1L-酪氨酸HCl 在 a) 静态条件下、b) 12 kHz MAS、c) 70 kHz MAS 和 d) 12 kHz MAS(使用 wPMLG 采集)的固态 NMR 谱。虽然 a-c 被观察到1H 单脉冲实验,d) 在 wMPLG 下观察到1H-1H 去耦。光谱是通过JNM-ECZ600R光谱仪在141 T静磁场下用2 mm HXMAS(a、b、d)和1 mm HXMAS(c)探头观察的。样品被填充到转子的整个体积中,没有任何垫片。
图2显示了wPMLG方案。 wPMLG是一个脉冲束,其相位由PMLG线性改变(通常是3到5个脉冲)1H-1H 这是一种解耦偶极子相互作用并在观察窗口中对其进行采样的测量方法。使用 z 旋转方法也很常见,该方法插入具有 180° 相移的块并沿 z 轴产生磁化 [4]。这减少了伪影,并允许为其他复杂序列轻松实现 wPMLG。
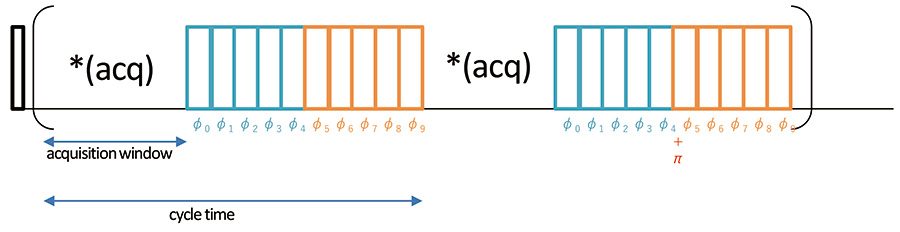
图2wPMLG 的脉冲方案1H 高分辨率方法。磁化强度由初始 90 度脉冲激发,并在随后的 wMPLG 照射下演变。 NMR 信号在每个采集窗口进行采样。 φk=φ最后(k+05)/5 对于 k=0-4 且 π+φ最后(95-k)/5,k=0-4φ最后由于历史原因,通常设置为 208 度,但可以更改,以提供额外的分辨率。[5, 6]
使用 wPMLG 实现高分辨率1为了获得1H固态NMR谱,优化测量条件非常重要。具体来说,周期时间,1H 偏移、采集窗口长度等。最佳条件取决于探头、MAS 频率和样品,因此需要对每个样品进行优化。这里我们介绍一下Pruski等人提出的优化方法。 [7]。为了调整参数,我们使用结合了 PMLG 照射的自旋回波方法(图 3)。自旋回波的信号强度是样品的T2’。固体样品的T2’是1H-1几乎由H偶极子相互作用决定,这个T2'最大化74084_74109|',即自旋回声后1H-1通过最大限度地减少氢偶极子相互作用来实现高分辨率1H NMR谱。
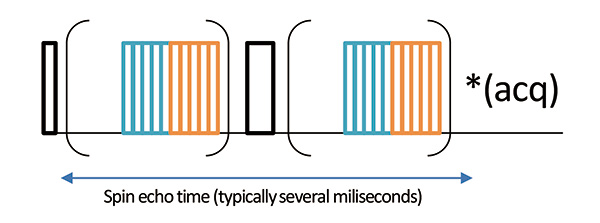
图 3回波演化期间使用 wPMLG 照射的自旋回波序列。请注意1在没有 wPMLG 照射的情况下观察到 H 信号。因此1H 分辨率不会更改参数。我们可以找到使信号强度.
测量流程
如前所述,每个参数的最佳值取决于样本,因此我们建议使用实际样本而不是标准样本来优化参数。特别重要的参数是周期时间、偏移和 MAS 频率。首先,调整循环时间。首先,将偏移设置为 5ppm(或其他值),将 RF 磁场设置为 120-160kHz [6]。该磁场强度是一般 MAS 探头的最大磁场强度,因此将 obs&pmlg 设置为 100%。图 4 显示了自旋回波谱,循环时间从 10 us 到 50 us 以 1 us 为增量变化。
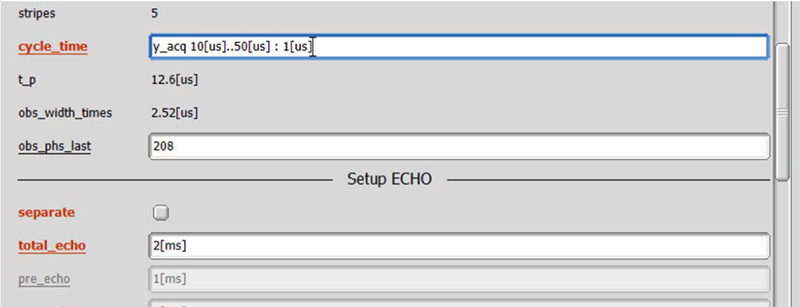
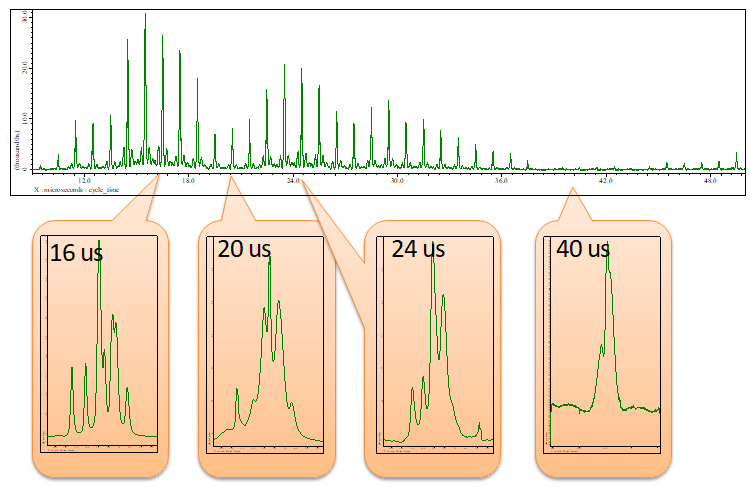
图 4一套1141 T、12 kHz MAS 下 L-酪氨酸HCl 回波时间期间 wPMLG 解耦的 H 自旋回波谱(见图 3)周期时间(在图 2 中定义)每 1 微秒从 10 到 50 微秒不等。总自旋回波持续时间设置为 2 ms。插图显示了在每个循环时间获得的代表性 wPMLG 光谱。
如图4所示,自旋回波强度随cycle_time变化,在cycle_time = 16 us时获得最大强度。观察图4所示的wPMLG谱,我们可以看到自旋回波强度和wPMLG谱的分辨率直接相关。例如很宽1H 在cycle_time = 40 us时,获得wPMLG谱,自旋回波强度几乎为0,而在cycle_time = 24 us时,获得自旋回波强度的极值,在cycle_time = 16 us时,获得最大值,高分辨率1H wPMLG 光谱。此外,自旋回波强度较高的16 us光谱具有更高的光谱分辨率。下一个1优化水平偏移。1可以使用自旋回波方法以与cycle_time相同的方式执行H偏移优化,并且1H wPMLG 光谱也可以直接观察。两种方法都可以,但后者可能更好,因为在 wPMLG 测量中可以观察到伪影。在使用像 wPMLG 这样的观察窗口进行测量时,总会出现伪影,因此必须将其放置在光谱区域之外,或者至少进行调整,使其不与感兴趣的峰重叠。输入上一步中获得的最佳值(图 4 中的 16 us)作为 Cycle_time,并以 1 ppm 为步长将 X_offset 从 -15 更改为 15 ppm(图 5)。此处,在 10 ppm 处获得了最高分辨率光谱。 Cycle_time 和 x_offset 按顺序优化,直至收敛。请确保观测时间 acq_time(=x_points*cycle_time) 小于 50 ms。观察期间几乎连续1H RF 正在被照射,因此如果将其延长超过此时间,将会导致探头发生故障。
脉冲程序:wpmlg5jxp标准:最大化分辨率,避免伪影与峰值重叠。
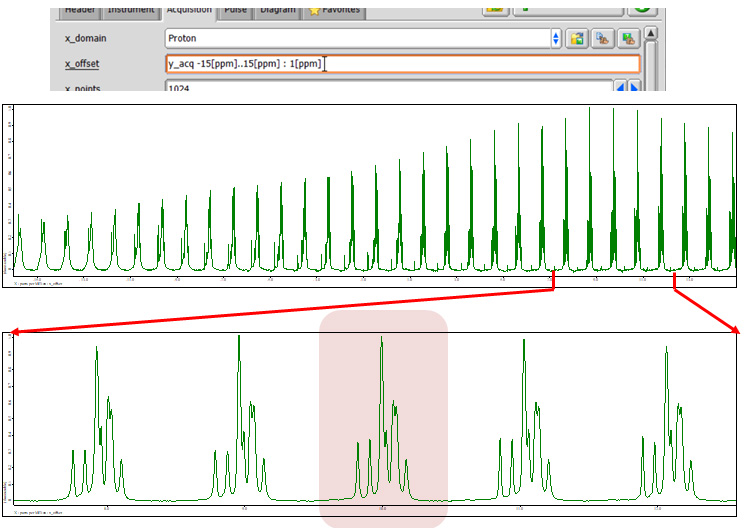
图 5一套1L-酪氨酸HCl 在 12 kHz MAS、141 T 下的 H wPMLG 光谱。1H 偏移量每 1 ppm 从 -15 到 15 ppm 变化。
如上所述,x_offset 可以通过自旋回波强度进行优化(图 6)。最大强度与在 x_offset=10ppm 时使用 wPMLG 观察到的结果相符,但由于尚不清楚自旋回波会在何处出现伪影,因此最好在直接使用 wPMLG 观察时进行调整。
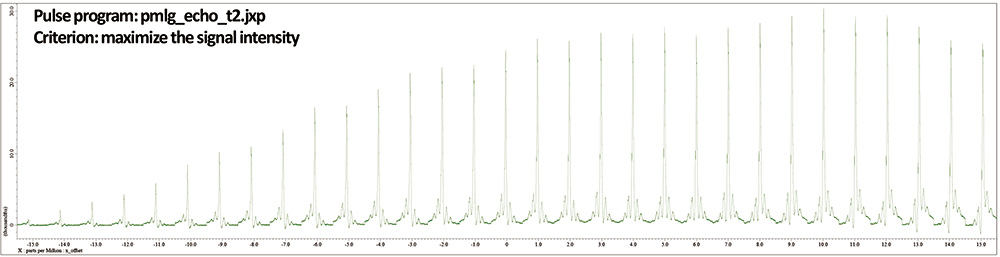
图 6一套1L-酪氨酸HCl 在 12 kHz MAS、141 T 下的 H 自旋回波 (wPMLG) 谱。1H 偏移量每 1 ppm 从 -15 到 15 ppm 变化。
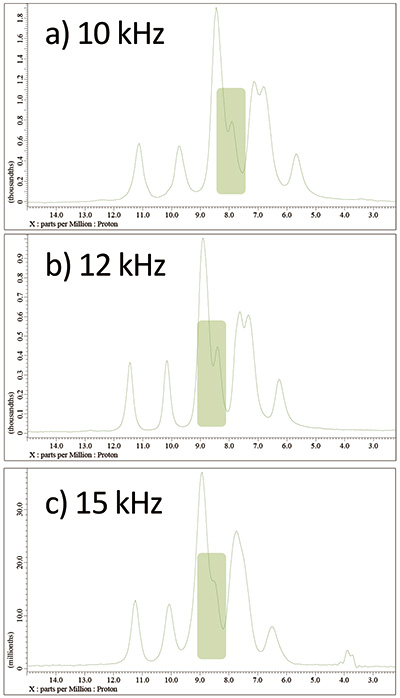
图 7L-酪氨酸HCl 在 141 T、a) 10 kHz、b) 12 kHz 和 c) 15 kHz MAS 下的 wPMLG 光谱。在每个 MAS 速率下优化后显示光谱。
最终可实现的分辨率取决于 MAS 频率。此外,更快的 MAS 并不一定意味着更好的分辨率。当实际在10、12和15 kHz进行调整时,在12 kHz处获得了分辨率最好的频谱(图7)。因此,如果可能的话,我们建议在多个 MAS 频率上进行调整。这也避免了错误分配工件。例如,如果您不确定图 7 中浅绿色标记的部分是否是伪影,那么如果您在几个 MAS 频率上对其进行比较,您可以得出结论,它是一个真实信号,因为它出现在每个频率上。为了进一步提高分辨率、采集窗口、射频磁场强度,φ最后[5, 6] 等。由于 wPMLG 对 RF 磁场的均匀性也很敏感 [8],因此通过使用垫片减少样品体积可以获得更好的分辨率。
如何区分伪影和真实信号?
第一种方法是比较在不同 MAS 频率下优化的频谱,如上所述。另一种或附加方法是在相同 MAS 频率下比较具有不同参数的频谱。图8显示了offset(a)和cycle_time(b)在12 kHz MAS下如何变化。随着参数的变化,工件会出现在不同的位置(或不出现),因此您可以轻松查看它们出现的位置。这样,通过在不降低分辨率的范围内更改这些参数,您可以移动伪影的位置,使其不会与感兴趣的信号重叠。
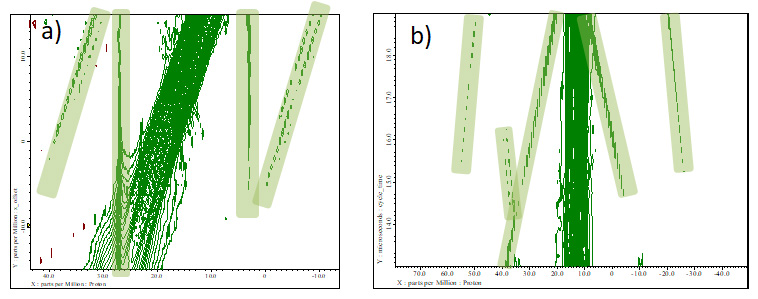
图8一组 L-酪氨酸HCl 在 12 kHz MAS、141 T 下的 wPMLG 光谱,具有不同的 a) 偏移和 b) 循环时间。文物用绿色标记。
数据处理
经过上述调整后的高分辨率1我能够获得 H 谱。然而,wPMLG 的 ppm 刻度小于实际的化学位移,因此在数据处理过程中必须使用比例因子进行校正。处理分两步完成:1) ppm 重新调整和 2) 参考校正。首先,1) 中的重新缩放需要两个具有已知化学位移的峰。由于使用真实样品通常很难做到这一点,因此 wPMLG 测量是使用标准样品进行的。可以使用标准样本来优化偏移,但其他参数应与使用实际样本优化的参数相同。作为示例,我们将介绍使用L-酪氨酸HCl作为标准样品的情况。用70kHz MAS测得的高分辨率光谱两端峰之间的化学位移差为1006 ppm(图9)。 wPMLG 光谱中的化学位移差为 519 ppm,因此比例因子为 519/1006 = 0516。将“线性参考”(显示->参考->线性参考)插入到进程列表中,并在“alpha”中输入比例因子的倒数。此过程校正了 wPMLG 两端之间的化学位移差异,结果为 1006 ppm。如果您没有 L-tyrosineHCl 或者没有超高速 MAS 探头,最好参考具有文献值的样品。这样就完成了横轴缩放校正。接下来,设置参考。
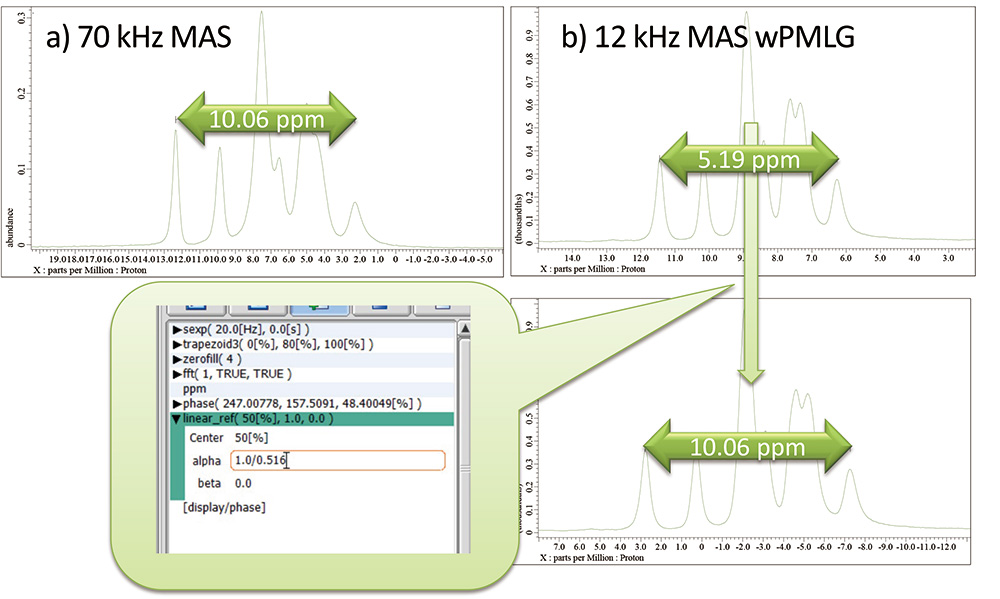
图9a) 70 kHz MAS 下的自旋回波和 b) 12 kHz MAS 下的 wPMLG L-酪氨酸HCl 在 141 T 下的光谱。化学位移的分离通过过程列表中的 Linear_ref 函数进行校正,从而得到正确的峰分离。
如果所用标准样品的 MAS 谱中有清晰的峰,则可以进行参考设置。例如,如图 1b 所示,即使使用 12 kHz MAS,L-酪氨酸HCl 在 122 ppm 处也有峰值,因此我们使用它。如果标准样品的 MAS 光谱中没有清晰可见的峰,请使用所有相同的参数(包括偏移)获得高分辨率光谱。最终参考设置在“参考”(显示 -> 参考 -> 参考)中进行。经过 Linear_ref 处理后最左边的峰位置为 276 ppm,但该峰的正确位置是 122 ppm,因此在“Position”中输入 276 ppm,在“Reference”中输入 122 ppm。最终获得的 wPMLG 频谱以及超快 70kHz MAS 频谱如图 10 所示。使用wPMLG方法,我们能够获得与超快MAS光谱相当的光谱,但在某些位置具有更高的分辨率。
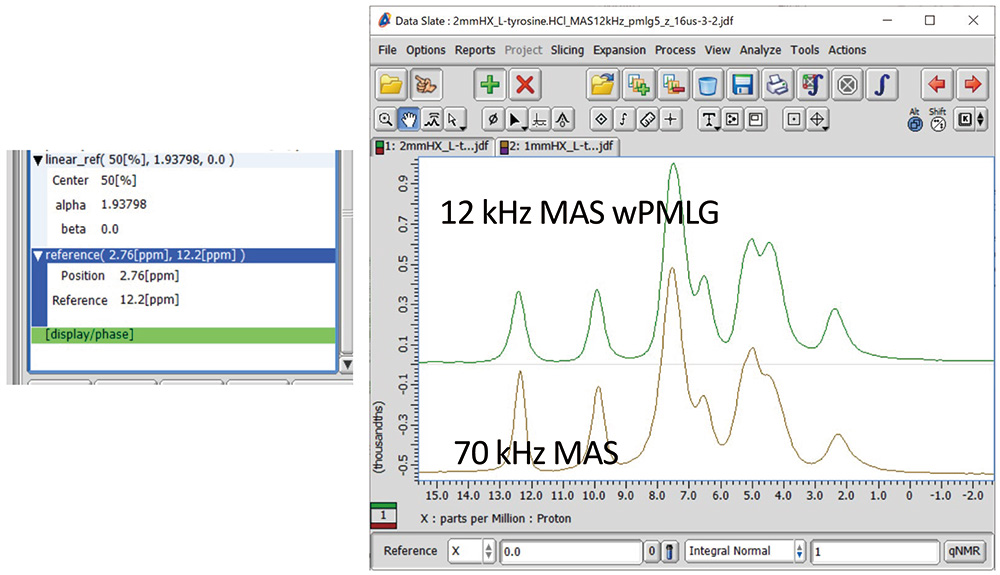
图 10L-酪氨酸HCl 之间的参考处理(左)和一维比较170 kHz MAS 下的 H 单脉冲(棕色)和 12 kHz MAS 下的 wPMLG(绿色)。
参考文献:
- [1] KR莫特 (Mote),V 阿加瓦尔 (Agarwal),PK马杜,Prog。核。马格。共振。 Spectrosc 97 (2016) 1-39
- [2] Y Nishiyama,固态核。马格。共振。 78(2016)24-36。
- [3] E维诺格拉多夫,PK Madhu,SVega,化学。物理。莱特。 5-6 (1999) 443-450。
- [4] M Leskes,PK Madhu,SVega,JChem。物理。 128(2008)052309。
- [5] X Lu、O Lafon、J Trebosc、ASL感谢西山 (Y Nishiyama)、甘 (Z Gan)、PK马杜,J-P。 Amoureux,J Magn。共振。 223(2012)219-227。
- [6] Y Nishiyama、X Lu、J Trebosc、O Lafon、Z Gan。 PK马杜,J-P。 Amoureux,J Magn。共振。 214(2012)151-158。
- [7] K Mao,M Pruski,J Magn。共振。 203(2010)144-149。
- [8] J Hellwagner、L Grunwald、M Ochsner、D Zindel、BH迈尔 (Meier),M 恩斯特 (Ernst),马格 (Magn)。共振 1 (2020) 13-25。 doiorg/105194/mr-1-13-2020
- 点击此处查看此页面的可打印 PDF。点击打开新窗口。
 PDF 17MB
PDF 17MB
