天游线路检测中心 电子显微镜对生物样品的三维观察方法比较
JEOL 新闻第 50 卷第 7 期 春田智博JEOL 有限公司应用管理办公室
迄今为止,使用电子显微镜的三维观察是通过使用透射电子显微镜(TEM)的TEM断层摄影方法来进行的。近年来,随着计算机技术的进步和扫描电子显微镜(SEM)性能的提高,利用SEM的三维观察方法,如FIB-SEM、串行块面SEM(SBF-SEM)和阵列断层扫描越来越受到人们的关注。这些方法比TEM断层扫描具有更广泛的观察范围,因此有望应用于生物样品,并取得了一些成果。尽管这些方法各有其特点,但使用同一样本对这些特点进行比较的例子却很少。因此,我们利用TEM断层扫描、FIB-SEM、SBF-SEM和阵列断层扫描对同一样品进行了三维观察,通过比较这些结果,我们考虑了每种方法的优缺点以及适合的样品和分析方法。
简介
构成细胞的细胞器和蛋白质复合物的三维结构和定位对于理解组织和细胞的功能和作用非常重要。这些信息不仅对基础研究有用,而且对开发严重疾病的治疗方法和药物也有用。到目前为止,TEM 断层扫描已用于对这些微观结构进行三维观察。在 TEM 断层扫描方法中,通过拍摄薄膜样品的连续倾斜图像并对获得的图像进行背投影来重建三维图像。尽管这种方法提供了非常高的分辨率,但允许电子束穿过的样品厚度存在限制。因此,利用这种方法很难对整个细胞或组织进行三维结构分析。然而,近年来,组织学和细胞生物学与分子细胞生物学密切相关,阐明微观结构的形态和分布如何影响整个组织和细胞非常重要。为此,在保持电子显微镜分辨率的同时可以观察整个细胞和组织的观察方法的开发正在取得进展,其中三种三维观察方法:FIB-SEM、SBF-SEM和阵列断层扫描正在引起人们的关注[1,2,3](图1)。FIB-SEM 在 SEM 上安装有聚焦离子束 (FIB) 镜筒,可使用 FIB 进行处理并使用 SEM 观察处理结果。 FIB是一种在生物样品分析中不太熟悉的设备,但它用于材料领域,可处理无法用金刚石刀切割的金属和矿物,将样品打薄并表面进行SEM观察。为了使用 FIB-SEM 方法观察三维结构,用 FIB 刮擦样品表面,然后用 SEM 观察新暴露的表面 [1]。通过重复该切割和图像采集并堆叠所获得的连续截面图像来重建三维图像。 FIB-SEM方法的优点是可以高精度地确定切割位置,并且使用离子束可以将样品切割得比超薄切片机更薄。它还可以应用于无法用金刚石刀切片的金属和骨头等坚硬样品。另一方面,其缺点是由于在扫描离子束的同时进行切割,因此切割速度慢且切割范围窄。SBF-SEM法是在SEM样品室内内置用金刚石刀切割样品表面的机构,在SEM样品室内切割样品表面,并使用SEM观察新切割的表面的方法。与FIB-SEM类似,重复切割和观察,并通过堆叠观察到的图像来重建三维图像[2]。 SBF-SEM方法的优点是用金刚石刀切割样品,因此切割速度快,一次可以切割较宽的切割面。另一方面,其缺点包括需要使样品导电才能观察大块样品的表面,无法进行后染色,以及需要使用NCMIR方法[3]等样品固定方法来弥补无法获得高对比度图像的缺陷。 NCMIR方法进行两次OsO4固定,并用乙酸双氧铀和天冬氨酸铅进行封闭染色,在样品形态的保存方面逊于普通的双重固定方法。另外,虽然通过NCMIR法提高了样品的导电率,但根据样品的不同,当照射用于SEM观察的电子束时,观察到的样品也可能带电。最后一项是阵列断层扫描。在阵列断层扫描方法中,使用超薄切片机制备连续超薄切片并将其附着到硬质导电基底(例如硅晶片)上。通过使用 SEM 逐一观察这些连续切片样本并按顺序堆叠来进行三维重建 [4]。阵列断层扫描的优点是观察样品是硬质导电基板上的薄膜,因此充电困难;可以进行后染色,因此常规TEM制备的样品可以直接使用,并且其形态保存良好;如果您有常规的超薄切片机和扫描电镜,则不需要特殊的观察设备,因此初始成本可以保持较低。该方法与其他两种方法不同的另一个特点是,即使观察完成后,观察到的样本也不会丢失。另一方面,其缺点是需要经验丰富的技术来制备连续切片,并且SEM观察需要很长时间。由于这三种方法的原理相同,都是使用SEM观察连续切割表面,因此对这三种方法之间的性能和特性很少进行比较或讨论。因此,在本研究中,我们将使用三种类型的SEM三维观察方法和TEM断层扫描来观察同一样品,比较获得的三维图像,并讨论每种观察方法的特点。此外,根据获得的三维重建图像,我们分析了宿主大肠杆菌的大小、其中包含的噬菌体的数量和定位以及噬菌体的类型和定位之间的关系。
图1 各三维重建方法示意图
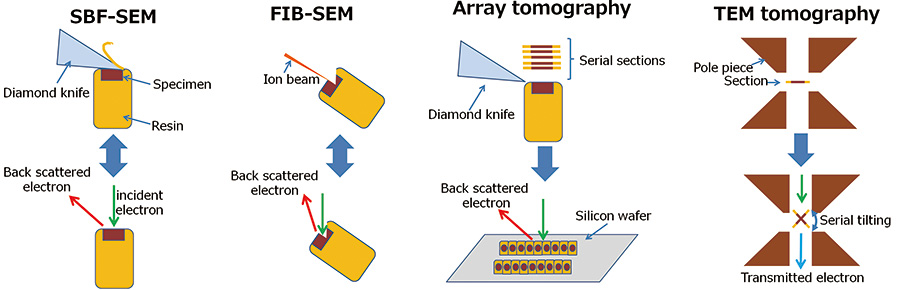
- SBF-SEM:通过在SEM的样品室中用金刚石刀反复切割样品并观察切割表面的背散射电子图像来进行三维重建。
- FIB-SEM:三维观察是通过在SEM的样品室中用窄聚焦镓离子束重复切割样品并观察切割表面的背散射电子图像来进行的。
- 阵列断层扫描:使用超薄切片机制备连续切片并收集在硬质基底(例如硅晶片)上。三维重建是通过将这些连续切片一一拍摄并按顺序堆叠来进行的。
- TEM 断层扫描:使用TEM拍摄连续倾斜投影图像,并使用CT方法使用这些倾斜图像进行内部结构的三维重建。
材料和方法
本研究以感染T4噬菌体、λ噬菌体、φ174噬菌体的大肠杆菌作为观察样本。噬菌体是一种感染大肠杆菌的病毒,其尺寸最大小于200 nm,因此只能使用电子显微镜观察其形态(图2a至c)。当噬菌体感染大肠杆菌时,它将其基因组(例如 DNA 或 RNA)注入细菌中,接管宿主细菌的转录、翻译和复制功能,并在细菌内繁殖。此时,在大肠杆菌体内可以观察到无数的噬菌体颗粒(图2d至f)。当噬菌体在宿主体内充分繁殖时,它们会破裂宿主并离开宿主。然后它就有一个感染新宿主的生命周期。首先,我们将含有大肠杆菌的软琼脂培养基铺在硬琼脂培养基上,并通过滴加噬菌体溶液来用噬菌体感染大肠杆菌。此后,当培养大肠杆菌时,可以观察到被噬菌体感染的区域作为噬菌斑。切除该噬菌斑区域以获得噬菌体感染的大肠杆菌。用于 TEM 断层扫描和阵列断层扫描的样品前面添加了戊二醛,后面添加了四氧化锇溶液。将固定后的样品包埋在环氧树脂中,然后使用超薄切片机进行超薄切片。用于阵列断层扫描的连续超薄切片收集在硅晶片上。将该超薄切片用乙酸双氧铀和柠檬酸铅双重染色,并用作观察样品。用于 FIB-SEM 和 SBF-SEM 的样品通过 NCMIR [3] 进行了更强的重金属染色。根据样品的不同,FIB-SEM方法可以使用普通的双固定样品,但这次我们使用了NCMIR方法,其对比度更强。将固定并染色的样品包埋在环氧树脂中作为观察样品。观察条件如表1所示。使用Fiji[5]对通过FIB-SEM法、SBF-SEM法和阵列断层摄影法获得的连续切片图像进行对准,然后使用Stacker(由System Infrontier制造)进行三维重建。对于TEM断层摄影,使用TEMography(System Infrontia制造)来获取连续倾斜图像并进行三维重建。使用Colorist(System Infrontia制造)对获得的三维图像进行分割和定量分析。
图2 噬菌体TEM观察结果
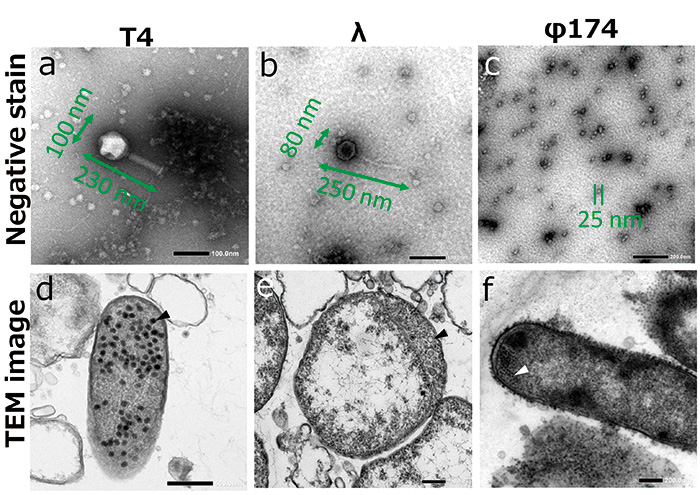
噬菌体 (a-c) 和在大肠杆菌内繁殖的噬菌体(d-f,箭头)的负染色图像。
表1 各种观察方法的成像条件
| SBF-SEM | 聚焦离子束扫描电镜 | 阵列断层扫描 | TEM 断层扫描 | |
|---|---|---|---|---|
| 仪器 | 配备 Gatan 3View 2XP 的 JSM-7800F | JIB-4610F | JSM-7800F | JEM-1400Plus |
| 采集区域(X,Y) | 24×24微米2 | 18×24微米2 | 19×24微米2 | 35×35微米2 |
| 采集深度 (Z) | 75 μm(50 nm × 150 图像) | 108 μm(20 nm × 543 图像) | 14 μm(70 nm × 20 张图像) | 200 纳米 |
| 像素大小 (X,Y) | 3纳米 | 94纳米 | 47纳米 | 172纳米 |
| 像素大小 (Z) | 50 纳米 | 20纳米 | 70纳米 | 172纳米 |
| 像素数 | 8192 × 8192 | 1920 × 2560 | 3840 × 5120 | 2048 × 2048 |
| 加速电压 | 10 kV | 30 kV | 70 kV | 120 kV |
| 采集时间 | 25 小时 | 48 小时 | 4 小时 | 1 小时 |
结果与讨论
使用电子显微镜的三维重建方法的比较
在这些条件下,我们首先使用 SBF-SEM、FIB-SEM(平面大块样品表面的 SEM 图像,加速电压分别为 1 kV 和 3 kV)、阵列断层扫描(硅片上的超薄切片样品,加速电压 7 kV)和 TEM 断层扫描(网状超薄切片的 TEM 图像,无倾斜,加速电压)分析感染 T4 噬菌体的大肠杆菌120 kV)。使用200kV观察二维图像。相比之下,观察大块表面的SBF-SEM和FIB-SEM的图像清晰度似乎不如观察超薄切片的阵列断层扫描和TEM断层扫描(图3)。这是因为,在该样品中,观察视野的大部分被仅由非导电性树脂构成的区域占据,并且以低加速度进行观察以防止在该区域中发生充电。使用阵列断层扫描方法拍摄的图像相当于 TEM 图像。这被认为是因为样品作为超薄切片附着在导电硅晶片上,因此即使相同的样品也可以在高加速电压下观察而无需充电。可见,提高电导率和高加速电压下的观察是利用SEM对生物样品进行三维观察的重要因素(图3c)。另外,可知SBF-SEM法及FIB-SEM法的观察中,虽然画质比超薄切片观察差,但仍维持了区分大肠杆菌内所含噬菌体粒子的分辨率。当我们对整个视场进行三维重建时,我们发现在TEM断层扫描中,切片的厚度(200 nm)小于大肠杆菌的厚度(约2 μm),因此即使是单个大肠杆菌的整个图像也无法三维重建(图4d)。另一方面,SBF-SEM和FIB-SEM方法成功地实现了大体积区域的三维观察(图4a、b)。在阵列断层扫描方法中,XY平面的宽度与SBF-SEM和FIB-SEM方法的宽度相当。然而,在本次实验中,由于重点是比较图像质量,因此厚度较薄,并且拍摄的图像数量为20张(图4c)。通过创建许多连续切片(这需要技巧)和增加图像数量,可以增加三维重建的厚度,尽管这需要时间。对整个个体进行三维重建后,将大肠杆菌噬菌体颗粒和细菌外膜分割,结果无论使用哪种方法,都能够观察大肠杆菌的外部形状和噬菌体颗粒的分布,尽管分辨率因方法而异(图4 e至h)。另一方面,当放大单个噬菌体颗粒时,SBF-SEM和阵列断层扫描方法相对于噬菌体颗粒尺寸的Z分辨率不足,因此它们在Z方向上显得拉长(图4i,k)。在FIB-SEM方法中,噬菌体颗粒的形态呈现圆形,但与TEM断层扫描方法的结果相比,细节被压碎,并且厚度方向的分辨率不足(图4j,l)。通过这种方式比较三维重建图像表明,虽然任何使用SEM的三维分析方法都可以定量分析大肠杆菌的形态并分析大肠杆菌内噬菌体的分布,但需要高空间分辨率的TEM断层扫描来观察噬菌体等微观结构的形态。当比较 SBF-SEM 方法和 FIB-SEM 方法时,获得了非常相似的结果,因为在样品室中处理和观察块状样品。这次,我们使用SBF-SEM和FIB-SEM观察到几乎相同的体积,但获取数据所需的时间SBF-SEM为25小时,FIB-SEM为48小时,相差约20倍(表1)。然而,从噬菌体颗粒的三维图像可以看出,FIB-SEM方法提供了比SBF-SEM方法更高的Z分辨率的三维重建。这是由于切割厚度分别为 20 nm 和 50 nm 的差异所致。这些结果总结在表 2 中。尽管 SBF-SEM 方法的图像质量不如其他方法,但其宽观察范围和吞吐量速度是其他方法无法比拟的。由于这一特点,SBF-SEM 方法被认为特别适合需要大体积三维重建的标本和分析。此外,由于可以通过增加加速电压来观察具有少量电荷的样本,因此认为可以提高图像质量。样本的一个例子是可以减少观察视野中仅树脂面积的大型组织样本,分析的一个例子是连接组等综合分析。FIB-SEM 方法比 SBF-SEM 方法需要更长的数据采集时间,但其特点是 Z 分辨率高。通过缩小观察范围,只能强调这个特性的优点。也就是说,FIB-SEM方法适合小组织样品和培养细胞作为观察样品。此外,高分辨率还带来高定量性能,使其与定量分析高度兼容。此外,由于可以切割骨骼和金属样品,因此它还可以应用于硬组织以及金属与组织之间的接触区域的三维分析。阵列断层扫描在观察后留下样本,但可以看出,需要连续切片技术和较长的成像时间来增加观察深度。因此,它适用于对广阔观测区域内的罕见现象进行详细分析的目的。由于样品残留,因此不仅可以进行重新观察,还可以使用透明基板对用光学显微镜观察的相同区域进行SEM观察。各种分析方法和应用也值得期待。此外,由于样品是导电基板上的薄膜,因此不易发生带电现象,并且可以在高加速电压下进行观察,这使得它可以有效地观察导电率低且被树脂包围的漂浮细胞、细菌和胚胎等样品。
图3 每种方法拍摄的图像的视野和图像质量比较
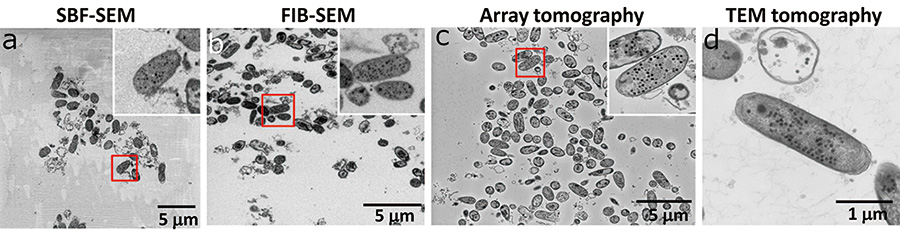
在SBF-SEM中,样品块具有较大的树脂面积,容易带电并导致图像质量下降(a)。与 SBF-SEM 一样,FIB-SEM 也观察样品块的树脂区域,但由于用于切割的镓被注入到表面,因此抑制了充电 (b)。在阵列断层扫描中,将样品制成薄膜并收集在高导电性硅晶片上,因此即使增加加速电压也不会带电,并且可以获得具有高信噪比的图像(c)。 TEM 断层扫描仅观察到一种大肠杆菌 (d)。
图4 3D重建结果对比

T4 噬菌体感染的大肠杆菌的三维重建。使用整个采集的视野 (a-d) 进行体绘制图像。大肠杆菌(绿色)、细胞内增殖的噬菌体(橙色)以及感染并粘附到大肠杆菌的噬菌体(粉色、白色箭头)的分割结果(e 到 h)。单个噬菌体的三维重建图像 (i-l)。
表2电子显微镜三维分析方法的特征总结
| SBF-SEM | 聚焦离子束扫描电镜 | 阵列断层扫描 | TEM 断层扫描 | |
|---|---|---|---|---|
| 视野 (X,Y) | 100μm以上 | 1~100μm | 100微米 | 少5微米 |
| 视场深度 (Z) | 非常深 | 深 | 窄 | 非常窄 |
| 3D 分辨率 (Z) | 50 纳米 | 20 纳米 | 70 纳米 | 1 纳米 |
| 采集时间 | 我们的几十年 | 有些日子 | 有些日子 | 1~2小时 |
| 努力获取 | 小 | 小 | 巨大 | 小 |
| 最佳样本 | 组织、大脑 | 组织、培养细胞 | 组织、胚胎、培养细胞 | 细胞器、病毒 |
| 最佳应用 | Conectome,详尽分析 | 形态观察、定量分析 | 定量分析,CLEM | 形态观察 |
三维重建图像分析
①T4噬菌体感染的大肠杆菌形态与内部噬菌体颗粒的关系
我们发现SBF-SEM也足以分析大肠杆菌的形态和噬菌体的分布。因此,利用SBF-SEM获得的数据,我们分析了感染T4噬菌体的大肠杆菌的形态与其封装的噬菌体颗粒之间的关系。首先,我们研究了大肠杆菌的体积与其所含噬菌体数量之间的关系(图5a)。结果,包封的噬菌体颗粒的最大数量为280个左右,没有观察到含有更多数量的噬菌体颗粒的大肠杆菌。这被认为是因为如果噬菌体颗粒的数量进一步增加,大肠杆菌就会破裂。另外,随着大肠杆菌体积的增大,包封的噬菌体颗粒数量趋于增加,但大肠杆菌和噬菌体颗粒的体积之间不一定是线性关系,即使体积相同,包封的噬菌体数量也存在差异(图5a中的B、C、D和E)。因此,我们提取了特征个体(图5a、c中的A-E)。提取的个体中,大肠杆菌体积较小,噬菌体颗粒较少(图5a、c中的A和B),有的体积增加不大,但含有较多噬菌体(图5a、c中的C-E),有的则大肠杆菌体积较大,噬菌体数量较多(图5a、c中的F)。为了了解噬菌体颗粒在这些个体中的定位如何变化,我们将大肠杆菌沿其长轴分为三个相等的部分:中心、中间和两端,并分析噬菌体颗粒分布在哪些区域(图5b)。结果,虽然内部噬菌体颗粒很少,但大部分噬菌体颗粒分布在大肠杆菌的中心。然而,随着内部噬菌体颗粒数量的增加,观察到集中在中心的噬菌体颗粒从中间部分向两端分散。此外,随着大肠杆菌体积的增加,中心的噬菌体颗粒数量减少,分布在两端的噬菌体颗粒数量增加。从大肠杆菌的形态来看,封装的噬菌体颗粒较少的大肠杆菌呈细长的棒状形状(图5c:B),但当封装的噬菌体颗粒数量增加时,它在短轴方向膨胀并转变为桶形(图5c:C至E)。
图5 大肠杆菌形态与其所含噬菌体颗粒的关系
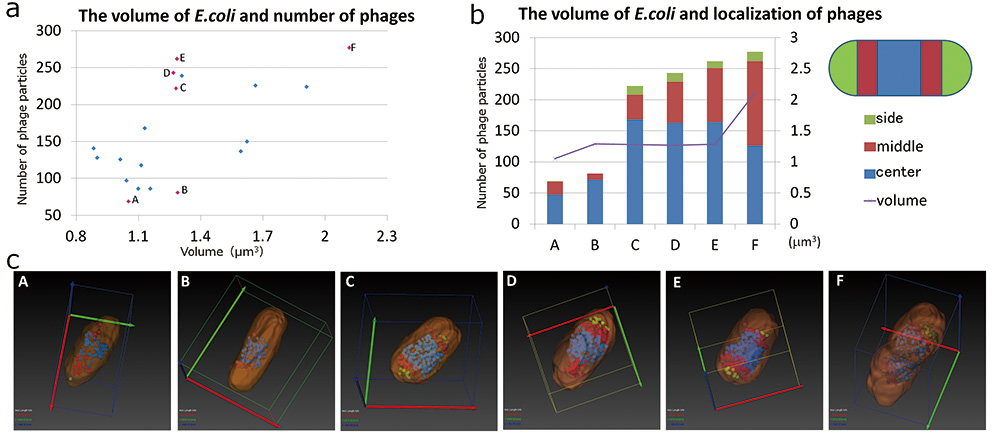
大肠杆菌的体积和其中包含的噬菌体的数量是根据通过SBF-SEM获得的感染T4噬菌体的大肠杆菌的数据绘制的(a)。我们选择了六种特征性大肠杆菌(图中粉红色表示,A 到 F),并使用分割来可视化大肠杆菌的形态和噬菌体的分布,因为它们封装的噬菌体的体积和数量发生变化(c),我们创建了一个图(b)。
②噬菌体类型与分布的关系
T4 噬菌体即使在大肠杆菌中也能强烈染色,并且可以使用所有三维重建方法进行区分。然而,λ噬菌体和φ174噬菌体在大肠杆菌内对比度较低,难以与细胞成分区分开,而且φ174噬菌体尺寸也较小,除非图像质量很高,否则难以观察(图2e,c,f)。因此,使用阵列断层扫描创建的三维图像来比较感染T4噬菌体、λ噬菌体和φ174噬菌体的大肠杆菌。首先,当我们关注感染噬菌体的大肠杆菌的形态时,我们发现感染λ噬菌体的大肠杆菌的形状从杆状变为球形(图6c)。接下来,我们将大肠杆菌分成嵌套在中心的三个部分、靠近细胞壁的部分和中间的部分,并研究每个噬菌体的分布位置(图6a)。结果,T4噬菌体和φ174噬菌体均匀分布在大肠杆菌内。然而,大多数 λ 噬菌体位于大肠杆菌细胞壁附近。 T4噬菌体和φ174噬菌体是裂解性噬菌体,当它们感染宿主时,它们立即开始在宿主内繁殖,导致宿主的破坏(裂解)。另一方面,λ噬菌体是一种溶原性噬菌体,当它感染宿主并将其基因组驱动到宿主体内时,它不会立即被裂解,而是将其基因组整合到宿主的染色体中并充当宿主的一部分(溶原性)。然而,当抑制噬菌体增殖的阻遏蛋白因环境变化而失活时,噬菌体开始增殖,宿主裂解。本研究中观察到的形态和定位差异可能是由于在溶原噬菌体中,转录、翻译和复制立即发生在植入的噬菌体基因组的位置,而在溶原噬菌体中,转录和翻译发生在宿主基因组上。此外,当我们通过将细菌细胞内部分成三部分来调查φ174噬菌体的分布时,发现没有偏差,但发现它集中在特定部分(图6d)。在这个实验中,无法确定初始感染的位置,但初始感染的位置和感染的位置之间可能存在关系。
图6 大肠杆菌噬菌体三维分布
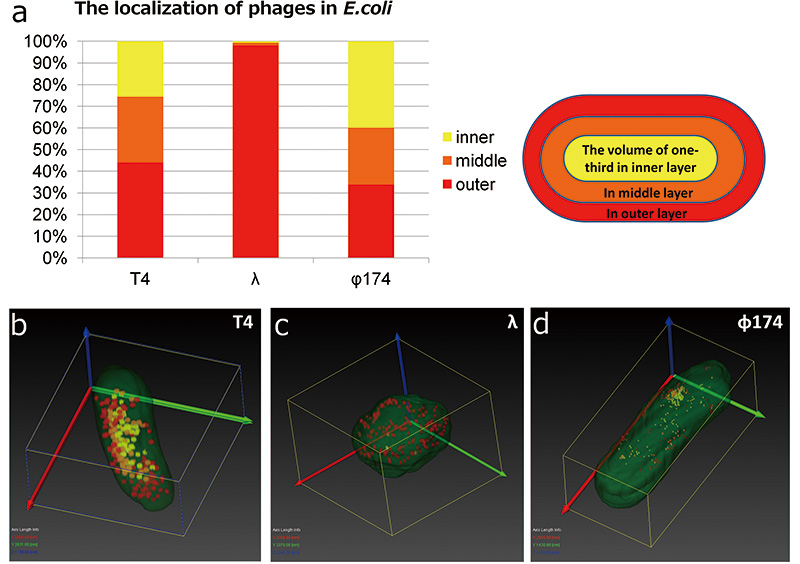
我们通过阵列断层扫描获得了感染 T4、λ 和 φ174 噬菌体的大肠杆菌数据,比较了增殖噬菌体的分布。将大肠杆菌分为中心、中部和外围(或内、中、外)三部分,并对每个区域的噬菌体数量进行计数。 T4噬菌体和φ174噬菌体在中央、中部和周围区域分布不明显,但λ噬菌体主要分布在外层(a)。此外,感染λ噬菌体的大肠杆菌的形态从杆状变为球形(c)。
结论
这些是使用与SBF-SEM、FIB-SEM和阵列断层扫描相同原理的三维重建方法,但可以说,根据所使用的样本类型以及所需分辨率等成像设备的条件,有些样本适合或不适合。虽然SBF-SEM方法和FIB-SEM方法中的数据采集是自动执行的,但随后的大部分分析是手动执行的。提取组织或感兴趣区域的分割通常是基于对比度进行的,但对比度本身可能不是决定因素,因为生物样本的对比度差异很小。因此,保持每张拍摄图像的高分辨率与分割工作的效率密切相关,因为它可以很容易地通过其形状来区分。此外,SBF-SEM法和FIB-SEM法需要引入特殊设备,而阵列断层摄影法可以用超薄切片机和SEM开始实验,但所需的劳动力很大。因此,针对要观察的样本和研究目的选择使用哪种三维分析方法是高效进行研究的重要策略。我们希望本文对正在考虑使用电子显微镜进行三维观察的研究人员有所帮助。
致谢
本文是日本细胞生物学学会第 69 届年会 ASCB-EMBO 2017 会议上提出的内容的修订版。大肠杆菌和噬菌体由国立技术评价研究所提供。此外,我们还要感谢 JEOL 员工在撰写本文时提供的帮助和配合(Yuki Yamaguchi 对 SBF-SEM 方法进行技术指导和讨论,Hideki Matsushima 对使用 FIB-SEM 方法进行数据采集,Mitsuo Suga 使用阵列断层扫描方法进行数据采集,Keiko Hasumi 对数据采集后的分割进行处理,Hideo Nishioka 对整体研究指导和管理)。我想借此机会向您表示感谢。
参考文献
- Knott G、Marchman H、Wall D、Lich B。使用聚焦离子束铣削对成人脑组织进行连续切片扫描电子显微镜观察。神经科学杂志. (2008).
- 米切瓦 KD,史密斯 SJ。阵列断层扫描:一种对神经回路的分子结构和超微结构进行成像的新工具。神经元. (2007).
- Deerinck, T J 和 Bushong、Eric 和 Thor、A 和 Ellisman、Mark。 3D EM 的 NCMIR 方法:用于串行块面扫描电子显微镜制备生物样本的新协议。国家中心显微图像研究中心. 6-8. (2010).
- Denk W,Horstmann H。串行块面扫描电子显微镜重建三维组织纳米结构。公共科学图书馆·生物学. (2004).
- Schindelin J、Arganda-Carreras I、Frize E、Kaynig V、Longair M、Pietzsch T、Preibisch S、Rueden C、Saalfeld S、Schmid B、Tinevez JY、White DJ、Hartenstein V、Eliceiri K、Tomancak P、Cardona A。斐济:生物图像分析的开源平台。自然方法. (2012).
