天游线路检测中心 生物电子显微镜为生物研究新发现寻找更重要的数据

采访 08
伦敦大学国王学院罗兰·弗莱克教授
了解细胞和分子的结构在生物医学研究中极其重要。英国伦敦国王学院 CUI(超微结构成像中心)主任 Roland Fleck 教授与 JEOL 合作,一直致力于使用 JSM-7800FPRIME 扫描电子显微镜 (SEM) 和 JEM-F200 透射电子显微镜 (TEM) 对生物体等结构进行高分辨率观察。 JCAT(JEOL 先进技术中心)与 CUI 内的 JEOL 合作建立,利用正常室温下的电子显微镜和极低温度下的冷冻电子显微镜进行研究。
为什么理解复杂的生物过程很重要
Fleck 教授是伦敦国王学院 CUI(超微结构成像中心)的负责人,致力于使用 TEM 和 SEM 等先进成像技术来进一步了解复杂的生物过程。 “生物过程”指的是各种各样的生物现象,包括基因组形成、信号转导、细胞周期进程和其他复杂系统。
人体有各种专门负责不同功能的器官。我们用眼睛看,用脚走。个体功能(看、行走、抓握)发生在所有空间尺度上。在眼睛中,每个晶状体和感光细胞都有助于视觉,并且聚集在每个感光细胞不同部分的不同分子执行各自的任务(一些分子检测光,另一些分子通知大脑它已检测到光)。然而,为了观察和研究分子的运作,需要大约100万倍的放大倍数。这是普通光学显微镜无法实现的,需要使用波长较短的电子束的显微镜。然而,使用电子显微镜可以观察的物体仅限于极薄的生物组织样本,相当于人类头发厚度的千分之一。要看到整个细胞,必须观察数百个薄片。
为了观察细胞和生物组织,首先需要准备适合电子显微镜的样品。如何进行样品制备需要许多不同领域的专业知识。此外,需要进行研究以更好地了解样品制备程序对样品的物理化学效应和影响,并对其进行优化。 Fleck 教授通过自己的研究,寻求改进样品制备方法,以便从生物样品中获得更高质量的信息。 “因此,我们与 JEOL 的合作关系非常有价值,”Fleck 教授说道。
生物组织的冷冻标本制备
生物组织由细胞群组成。比如,心脏这个“器官”,是由心肌、血管、神经等生物组织组成,这些组织按照一定的顺序连接起来,发挥着各种作用。因此,为了了解活体组织的功能,有必要阐明它们的形态和结构。
冷冻(极低温)电子显微镜可以通过将活组织冷冻在“活”状态并将其保持在低温下来观察它们。冷冻样品在极低的温度下保持冷却,并在连接电子显微镜的“冷冻”台上观察。防止样品冷冻过程中形成结晶冰(将样品嵌入非晶冰中)是提高冷冻电子显微镜图像质量和分辨率的关键。这是因为冰晶的形成会对样品的原始结构造成破坏。通过嵌入无定形冰中,可以观察“活”状态下的生物组织的结构,避免了化学固定和脱水处理造成的伪影以及细胞内冰形成造成的超微结构崩溃。
弗莱克教授使用多种冷冻技术来防止冷冻过程中冰晶的形成。使用液体乙烷或丙烷等中间冷却器进行快速冷却可以防止称为莱顿弗罗斯特效应的现象,即绝缘蒸气膜减慢冷却速度,并允许将少量样品嵌入非晶冰中。该方法由 2017 年诺贝尔化学奖(冷冻电子显微镜)获得者之一雅克·杜博切特 (Jacques Dubochet) 建立,允许将分离和分散的小颗粒(如水溶液中的生物分子)嵌入无定形冰中,以创建用于单颗粒分析的薄膜 TEM 样品。对于由全细胞或生物组织组成的厚样品,则使用高压(高压)冰箱。高压冷冻是基于水的物理特性。 21×108Pa(2,100 巴)的压力充当物理冷冻保护剂。高压抑制了水结晶导致的体积膨胀,减慢了冰晶形成的速度,并降低了非晶冰形成所需的临界冷却速度(10,000°Cs-1)。将嵌入无定形冰中的生物组织块样品在低温(极低温度)下冷冻替代、切片或切割,并用冷冻SEM直接观察,或者制作用于TEM观察的复制品并用TEM观察。弗莱克教授正在努力充分利用这些尖端技术来阐明各种问题。例如,高压冷冻现在与神经细胞的电刺激和光刺激相结合,通过实现高水平的刺激固定时间相关性,对于研究活体大脑中神经细胞(神经元)之间传输的信息非常有用。
在光学显微镜中,荧光标签用于显示活细胞隔室中捕获的蛋白质。然而,该方法无法观察作为细胞功能基础的超微结构。尽管电子显微镜具有观察细胞超微结构的分辨率,但它无法“看到”附着在特定蛋白质上的荧光标签,因此无法识别细胞内存在的蛋白质。因此,采用“免疫金标记法”。该技术利用抗体与抗原细胞和/或组织的特异性结合,使用电子显微镜可视化特定细胞和/或组织的位置(定位)和形态。该方法采用冷冻超薄切片法(Tokuyasu法),通过在样品中引入蔗糖(蔗糖)作为冷冻保护剂,当将样品直接浸入液氮(约<100℃s-1)中并冷冻时,即使在相对较慢的冷却速度下也可以抑制冰晶的形成。然后使用冷冻超薄切片机方法对冷冻的生物组织进行切片,并用免疫抗体金颗粒进行标记。
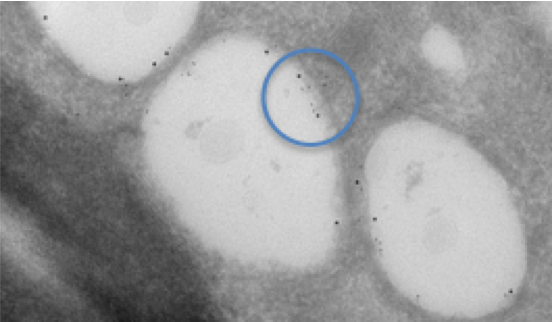
图 1 使用免疫金标记对感染丙型肝炎病毒的细胞中的脂滴进行双重标记。蓝色圆圈表示双号。两种不同的蛋白质被不同大小的金胶体标记。可以看出,每种蛋白质都单独定位于脂滴的内膜。用于该观察的组织是使用冷冻超薄切片法(Tokuyasu法)制备的。
在寄生虫学中使用 SEM 和 TEM 了解细胞和分子结构的重要性
阐明疟疾的细胞和分子结构对于开发预防疟疾感染的药物至关重要。疟疾寄生虫(恶性疟原虫)在膜封闭的红细胞内发育,并包含在寄生液泡内。在发育过程中,疟疾改变了红细胞的表面特性,导致其细胞骨架变得僵硬,对疟疾粘附的细胞的细胞骨架产生“剪切应力”,从而导致进一步传播。一旦疟疾寄生虫完全发育,就会发生一个称为“排出”的多步骤过程。为了实现这一目标,原生动物巧妙地协调了高度受控的、连续的细胞膜透化和破坏过程,最终导致原生动物通过细胞破坏而爆炸性释放,从而导致新的感染周期。
了解这些过程是揭示疟疾生命周期的关键。电子断层扫描对于这项研究是有效的。电子断层扫描是一种利用计算机处理连续倾斜拍摄的样品的大量图像以重建样品的三维内部结构的方法。
Fleck教授使用冷冻电子断层扫描技术观察高压冷冻置换的感染红细胞样本和快速冷冻的红细胞影细胞样本,以检查红细胞表面的三维变化。高度组织的“旋钮状”细胞骨架由涂有电子致密层的螺旋结构组成,形成旋钮状膜结构的基础,并通过多个链接与红细胞细胞骨架连接。 Fleck 教授还使用高分辨率冷冻断裂扫描电镜来观察这种旋钮状结构中膜蛋白的排列。这些样品是通过高压冷冻活寄生虫制成的。利用高分辨率SEM图像揭示了膜蛋白的结构,旋钮状结构与周围红细胞膜清晰可辨,并且发现旋钮的顶端是与周围红细胞粘附的部位。因此,被恶性疟原虫感染的红细胞的旋钮状结构被发现包含位于特定细胞膜区域下方的高度组织化的骨骼结构。
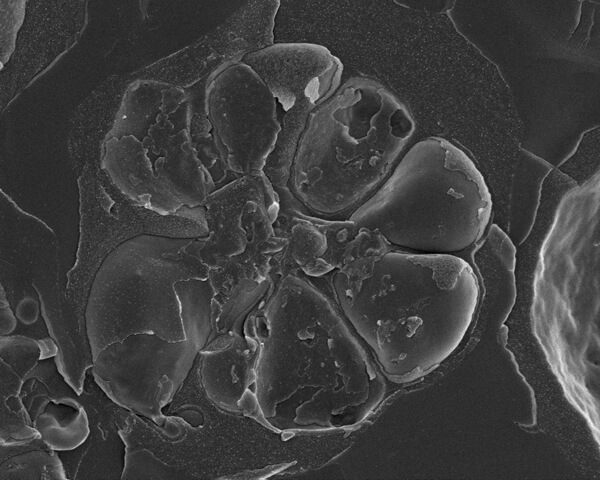
图 2 疟疾寄生虫(恶性疟原虫)在红细胞内发育。膜封闭的寄生液泡包含七个裂殖子(子体),排列在中央残留体周围。由于样品的切割过程,许多单独的膜是可见的。
使用串行块面 SEM 进行三维重建
大脑研究极其重要。这是因为澄清大脑神经元之间的连接将有助于理解学习和记忆的机制。当前的一个主要目标是“连接组分析”,它揭示了大脑中所有神经元之间的连接。在可视化神经元之间的连接时,TEM可以观察神经元之间的连接,但可观察的区域仅限于非常薄且狭窄的区域。 “串行块面扫描电镜 (SBF-SEM) 在克服这一限制方面非常有效,”弗莱克教授指出。
SBF-SEM 是一种使用 SEM 重建样品块三维结构的方法。它用于重建软样本(例如树脂嵌入的脑神经组织)的三维图像。使用SEM样品室中内置的超薄切片机,将尺寸为500μm以上的脑组织块样品的表面切割至约30nm的厚度,并使用SEM对每个表面进行拍照。然后通过反复切割和拍摄收集到的图像进行堆叠,获得样本块的三维结构。
SBF-SEM 观察引起的样品带电会导致所获得的图像数据的质量下降。因此,采用OTO(四氧化四氧/硫代碳锇)方法使样品块导电。该方法早在SBF-SEM出现之前就已开发出来,是一种增加脂质对比度的方法。 Fleck教授修改了这种传统的OTO方法并将其应用于SBF-SEM,允许对组织块样品进行均匀染色,同时避免产生大的染料沉淀物,从而导致强烈(过多)的反向散射电子信号,同时实现高样品电导率。Fleck 教授利用这种方法分析了海马体中突触前末端结构的分布,海马体在大脑的记忆和学习中发挥着基础作用,位于 CA1 上升层区域,该区域接收来自神经轴突有序阵列的输入。然后,来自多个区域的堆叠数据被重建为三维图像,教授的合作者将突触输入数据(使用电生理学技术获得)与脑组织中的参考标记进行匹配。树突兴奋性突触显示出不同的大小,但突触前和突触后结构之间存在很强的相关性。 (海马)在 CA1 锥体神经元基底树突上形成的突触末端按钮中,活动区(AZ,突触前递质释放位点)的大小随着按钮距离细胞体越远而减小。这导致突触传递的短期促进(由于高频输入而提高突触传递效率)随着距离细胞体越远而变得越强。这样,取决于树突上突触位置的短期促进的空间分布,可以补偿突触输入频繁刺激期间从突触传播到细胞体的电输入信号的衰减,微调树突上每个位置的输入频率的选择性。
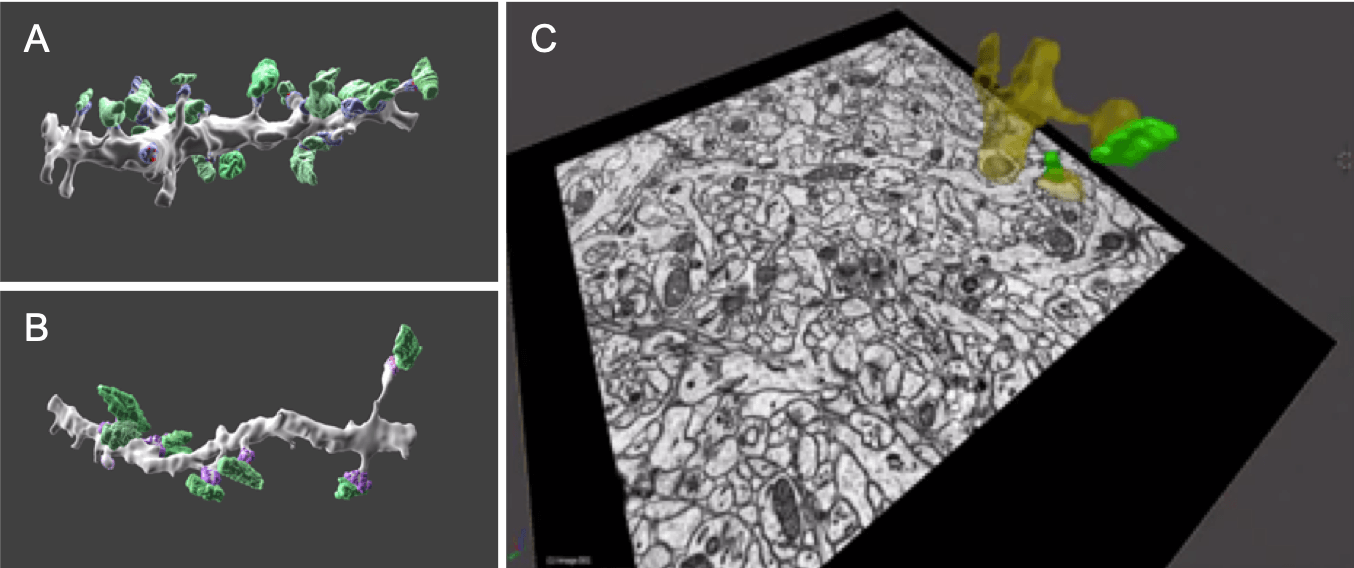
图 3 使用串行块面 SEM (SBF-SEM) 的海马神经元三维重建图像。在图像 A 和 B 中,突触前末端布顿以绿色显示,突触后密度以紫色显示。这里,A是靠近细胞体的树突的图像,B是远离细胞体的树突的图像。图像 C 显示了从样品块连续切割和观察的一个切片。重建的树突区域显示为黄色,突触前末端按钮显示为绿色,叠加在切片图像上。通过收集和堆叠许多切片图像,创建海马组织的三维重建图像。
结合了光学显微镜和电子显微镜的“光电子相关显微镜”
相关光电子显微镜 (CLEM) 是一种利用光学和电子显微镜互补特征的方法。首先,使用荧光显微镜识别荧光标记的蛋白质和组织的位置。接下来,使用电子显微镜以更高分辨率观察识别部分的形貌和结构。 CLEM广泛应用于生物科学,可以分析荧光标记的蛋白质、组织功能和微小形态(结构)。 CLEM 可以与 TEM 或 SEM 结合使用,并且可以配备专门的冷冻台,以利用荧光和冷冻电子显微镜的互补性。 Fleck 教授的 CUI 实现了众多 CLEM 工作流程。例如,通过在室温下连接尼康光学显微镜和 JEOL SEM,该设备允许细胞在特殊的组织培养皿中生长并作为活细胞进行观察。这些组织培养皿使得考虑细胞过程的光学显微镜观察数据与室温处理样品的SEM观察数据之间的相关性成为可能。
迈向生命科学的进一步进步
细胞生物学的新前沿是一种分析方法,它结合了冷冻电子显微镜和结构生物学方法,从嵌入非晶冰中的细胞和组织切片“原位”确定三维细胞结构。该技术需要冷冻电子显微镜以及冷冻固定和冷冻切片工具。此外,通过优化结合了最新聚焦离子束(FIB)装置和SEM的FIB-SEM(JIB-4700F,天游线路检测中心制造)以适应上述工具,可以使用FIB装置制备非晶冰的层状(薄膜)样品,然后将样品平稳地转移到冷冻TEM中进行观察,而不会污染样品。
Fleck 教授表示:“生物电子显微镜在过去十年中取得了重大进展。我们将继续与 JEOL 密切合作,迎接新的挑战。我们将交流并共同提出许多想法来开发最先进的设备。我很高兴能成为这个未来创新项目的一部分。” JCAT(JEOL 先进技术中心)在为社会做出贡献方面也发挥着重要作用。 JCAT 还为当地医院提供各种诊断肾脏和皮肤疾病的技术。例如,使用配备 JEOL RUBY 相机的 JEM-1400Plus 电子显微镜可以轻松进行生物检查。Fleck 教授强调:“与 JEOL 合作建立的 JCAT 将成为一个至关重要的平台。在这个尖端技术中心,我们相信我们的建设性合作将为新设备和技术带来创意,从而推动生命科学的进一步进步。”

罗兰·弗莱克
伦敦大学国王学院教授
先生Fleck 在苏格兰爱丁堡的赫瑞瓦特大学学习应用海洋生物学,然后就读于淡水生物学研究所,在那里他获得了博士学位,研究方向是“低温保存的淡水原生生物的细胞损伤和恢复机制”。在这项研究期间,他第一次开始使用电子显微镜,即 JEOL 的 JEM-100CX。获得博士学位后,他在美国康奈尔大学研究植物冷驯化。在那段时间,他特别致力于“冷冻断裂/冷冻蚀刻复制方法”。随后,他返回英国,在国家生物标准与控制研究所 (NIBSC) 开发并标准化了基于细胞的功能评估和分析方法,并参与了电子显微镜和冷冻成像设施的开发。现任伦敦大学国王学院超微结构成像中心(CUI)主任。
发布时间:2019 年 3 月
