天游线路检测中心 使用电子电离 (EI) 和光电离 (PI) 通过 GC×GC-HRTOFMS 分析石油样品中的生物标志物
JEOL 新闻第 50 卷第 8 期 冲方正明、上田义久天游线路检测中心 MS 业务部门
JMS-T200GC AccuTOF™ GCx-plus 是我们 GC-TOFMS(气相色谱飞行时间质谱仪)的最新型号,是一款高端 GC-MS,具有高质量分辨率,可以高速获取质谱。我们将介绍使用最新 GC-MS“光电离离子源”和 GC x GC 方法(GC 分离技术之一)相结合的系统对石油样品中的生物标志物进行分析的示例。
简介
近年来,随着气相色谱仪(以下简称GC)技术特别是毛细管柱技术的进步,开发出了多种具有多种分离能力的色谱柱。此外,还开发了应用先进毛细管柱技术的综合二维气相色谱系统(以下简称GC×GC),用于分离和分析成分更复杂的化学物质组[1, 2]。 GC x GC 由两种不同分离模式的毛细管柱串联而成,并在第一根和第二根柱之间安装低温冷阱系统(调制器),从而可以在一次分析中以两种分离模式进行分离分析。由第一级柱分离洗脱的组分被调节剂捕获一定时间(通常约5至10秒),然后立即引入第二级柱。第二根柱的内径较窄且长度较短,因此可以在很短的时间内(5 至 10 秒)分离,同时截留来自第一根柱的洗脱液。换句话说,来自第一根色谱柱的洗脱液在 5 至 10 秒的时间内被捕获,捕获的组分在第二根色谱柱中被分离。所得色谱图与正常色谱图不同,是具有两个时间(洗脱时间)轴的二维色谱图。四极杆MS(以下简称QMS)是一般GC-MS中使用最广泛的MS,但当将MS视为GC x GC的检测器时,很难说QMS是最佳MS。在GC×GC系统中,第二级色谱柱使用内径较窄、长度较短的色谱柱,并且由于第二级色谱柱中的分离是在5至10秒的短时间内进行的,所以所得色谱图的峰宽较窄。为了获得足够数量的窄峰宽色谱峰的数据点,要求检测器具有高的数据采集速度。然而,QMS 的数据采集速度是有限的,而且虽然也不是不可能使用 QMS 作为 GC x GC 的检测器,但存在一个问题,即第二维色谱图中的数据点数量有限,因此很难说它是 GC x GC 的“最佳 MS”。基于这样的背景,我们构建了GC x GC-TOFMS系统,将GC x GC与气相色谱飞行时间质谱仪(以下简称GC-TOFMS)相结合,具有较高的质量分辨率,可以高速获取质谱,自2004年以来一直用于各种复杂样品的分析[3-7]。在本文中,我们将介绍使用我们最新型号的 GC-TOFMS JMS-T200GC AccuTOF GCx-plus、其可选离子源“光离子源”以及结合 GC x GC 和光离子源的系统进行石油样品中生物标志物分析的示例。
GC×GC-PI-TOFMS系统
GC×GC系统
在我们公司,我们使用美国Zoex公司的产品作为我们的GC×GC系统。在两根柱子的连接处安装如图1所示的“调制器”,从第一根柱子洗脱出来的组分被调制器的冷射流在柱连接处冷冻捕获一定时间(5~10秒),然后被热射流加热一小段时间,然后送入第二根柱子。通过以固定时间间隔(5 至 10 秒)连续执行此操作,如图 2 所示,二维地执行色谱分离。
图1 GC×GC调制器原理图
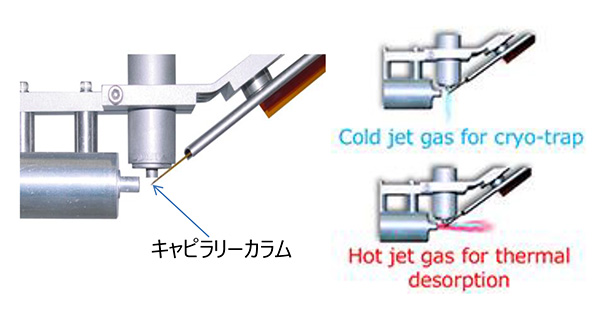
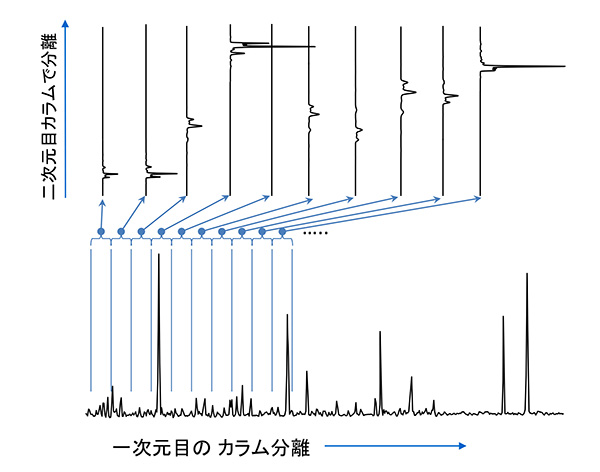
图2 GC×GC得到的二维色谱图概念图
光电离源 (PI)
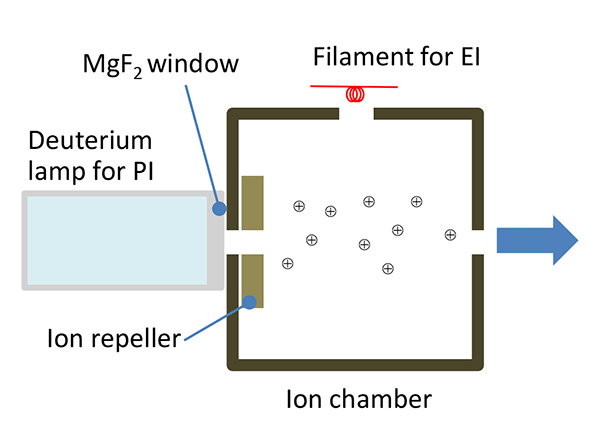
GC-MS 中最广泛使用的电离方法是电子电离 (EI) 方法,该方法具有高电离能并检测许多源自碎片离子的离子。获得碎片离子对于获得目标化合物的部分结构或通过质谱图谱库搜索来识别化合物是有用的,但从获得目标化合物的分子量信息或整个分子的元素组成信息的角度来看,它不是一种理想的电离方法,因为很难获得分子离子。使用如此高的电离能量的电离方法被称为“硬电离方法”,而在低能量状态下电离分析物的方法被称为“软电离方法”。化学电离(CI)法是GC-MS领域常用的软电离法,但除CI法外,我们还开发了利用真空紫外(VUV)光电离目标物质的光电离(PI)离子源,并将其作为GC-TOFMS(JMS-T200GC)或GC-QMS(JMS-Q1500GC)的可选离子源出售。此PI离子源采用辐射波长为115至400 nm的氘灯作为光源。该光源灯在115 nm低波长处的能量为108 eV,一般有机化合物的一次电离能在10 eV左右,因此与EI电离相比,使用该PI离子源的电离可以说是非常柔和(低能量)的电离。另外,如图3的示意图所示,该PI离子源还配备有用于EI电离的灯丝,通过关闭VUV灯并打开灯丝即可用作EI离子源。因此,用户可以在EI电离和PI电离之间顺序切换,而无需更改离子源周围的硬件。
图3 PI离子源示意图
高分辨率 TOFMS 系统
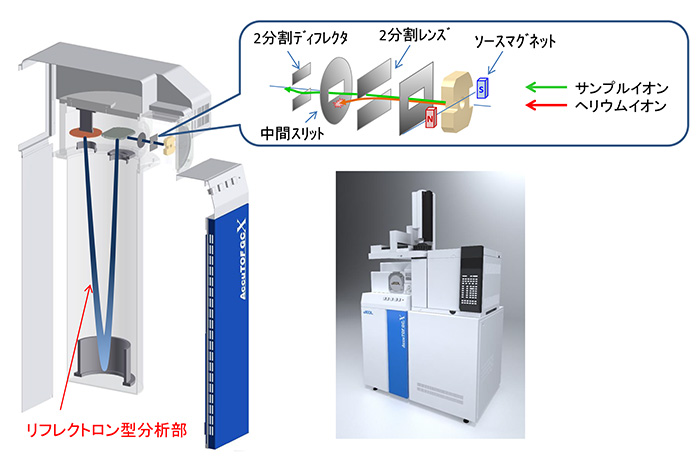
图。图4显示了JEOL AccuTOF™ GC系列的概述以及离子源、离子传输系统和离子光学系统的示意图。离子源和离子传输部分的作用是将GC引入的样品电离,并以30 eV左右的低动能将其传输到分析部分。GC-MS中,氦气用作GC的载气,氦气的量远大于目标化学品的量。在EI法中,该氦气也与样品同样地在离子源中电离并输送至分析部。此外,由于氦气产生的离子量极其巨大,因此会产生较大的空间电荷效应,包括向周围部件充电,从而对实际测量造成分辨率下降等不利影响。此外,由于飞行时间质谱仪的特性是引入分析部分的所有离子都会到达检测器,因此将大量氦离子引入分析部分会导致检测器快速劣化。因此,在该装置中,通过调节离子源中源磁体的平衡和离子传输系统的透镜电压,我们创建了一个离子传输系统,该系统消除了离子源中电离的999%以上的氦离子。此外,该装置的分析部分配备有单级反射器,从离子传输部分引入的离子在与离子传输方向垂直的方向上加速,然后流过反射器,使其成为垂直加速飞行时间质谱仪(OA-TOFMS)。
图4 JMS-T200GC各部分示意图
使用 GC×GC-PI-TOFMS 分析石油样品中的生物标志物
石油勘探的指标之一是对原油及其源岩中所含生物标志物的分析。生物标志物是生产石油的生物所特有的有机化合物,通过识别原油中所含的生物标志物,可以获取生产石油的烃源岩的有机质类型、沉积环境和成熟度等信息。然而,石油样品是多种碳氢化合物的集合,而被视为生物标志物的物质也是具有特定结构的碳氢化合物,因此全面检测石油样品中所含的生物标志物极其困难。在本报告中,我们尝试结合GC×GC的高分离分析能力、使用PI电离的碳氢化合物(特别是芳香烃)的软电离方法以及TOFMS的高质量分辨率来全面检测石油样品中的生物标志物。我们将介绍该分析的示例。
测量条件
详细测定条件总结于表1。本次使用的GC×GC系统为“Zoex公司制造的Zoex ZX2”,第一柱为弱极性柱BPX5(SGE公司制造,长度30m,内径025mm,液相厚度025)。μm),第二柱为极性柱BPX50(SGE制造,长度3m,内径01mm,液相厚度01μm)。这样,就使用了弱极性色谱柱和极性色谱柱的组合。使用原油馏分A和原油馏分B这两种测试样品,比较各自所含的生物标志物的量。
表1测量条件
| 仪器 | 天游线路检测中心 AccuTOF™ GC 系列 |
|---|---|
| Zoex ZX2 热调节器 | |
| 1圣专栏 | BPX5,30 m × 025 mm,025 μm |
| 2第列 | BPX50,3 m × 01 mm,01 μm |
| 调制器周期 | 6 秒 |
| 入口压力 | 350 kPa(流出流量:175 mL/min) |
| 入口模式 | 柱上冷却,炉轨模式,1 µL 进样 |
| 烤箱温度 | 50°C(2分钟)→ 10°C/分钟→ 250°C |
| 离子源 | EI/PI 组合离子源 |
| 电离模式 | PI+ (D2灯,115-400 nm) |
| m/z范围 | m/z 35~700 |
| 频谱记录速度 | 25 光谱/秒 |
测量结果
图。图5示出了当使用PI方法测量代表性生物标志物胆甾烷和金刚烷时获得的质谱。在任何化合物中,M+离子被检测为基峰,并且发现 PI 方法对于观察这些物质的分子离子非常有用。接下来,图6和图7显示了两种原油样品使用GC×GC/PI的二维TIC色谱图。一系列正丙烷 (CnH2n+2) 和环烷烃 (CnH2n+1),同时在所有样品中第二个柱的慢保留时间侧检测到许多化合物。通过分析PI获得的几个峰的光谱,我们发现这些化合物比正烷烃和环烷烃具有更高的不饱和度。nH2n-4YaCnH2n-6,CnH2n-8在完全相同的 GC x GC 条件下,对相同的两类原油馏分样品进行 EI 电离测量,测量了 CnH2n-4、CnH2n-6 和 CnH2n-8 对应峰的 EI。质谱库检索结果显示,原油馏分A中的这些化合物是以胆甾烷为代表的多环饱和烃,原油馏分B中的这些化合物是以金刚烷为代表的饱和交联环烃。因此,基于表2所示的六种通常被称为生物标志物的化合物的分子离子,基于PI方法的测量结果米/z创建高质量分辨率的二维提取离子色谱图(EIC)时,我们发现原油馏分A具体含有18-Norabietane、胆甾烷和藿烷,原油馏分B含有金刚烷、冰烷和金刚烷,如图8和图9所示。因此,为了系统地评估每种化合物中相关化合物的存在情况,生物标志物,CnH2n-4或 CnH2n-6,CnH2n-8的高质量分辨率二维EIC组合色谱图被创建。每个的总二维 EIC 如图 10 和图 11 所示。结果清楚地发现,由于碳原子数的差异,每种原油馏分中都含有与上述生物标志物相关的化合物。通过PI方法,可以选择性地观察每个生物标志物的相关化合物的分子离子,因此当与GC×GC的高分辨率相结合时,可以系统地评估生物标志物的丰度。此外,采用PI法和GC x GC相结合的测量结果发现,本次测量的不同原油馏分中所含的生物标志物存在差异。
图5 胆甾烷和金刚烷的PI质谱
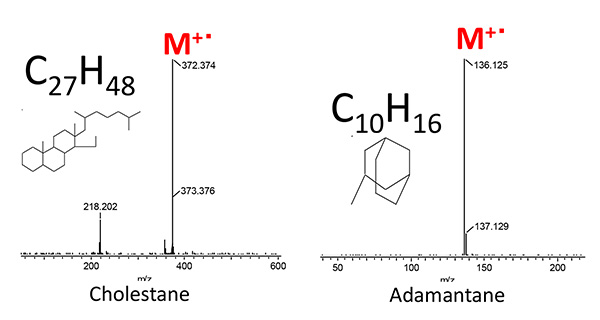
图6 原油馏分A的GC×GC/PI二维TIC
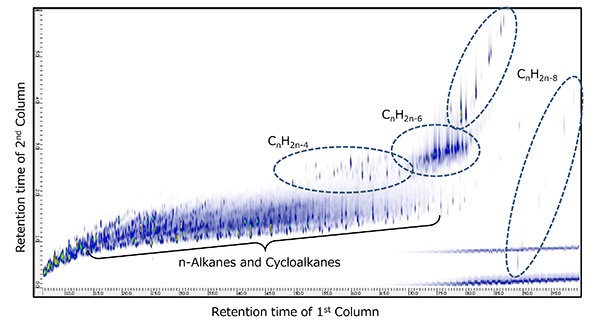
图7 原油馏分B GC×GC/PI 二维TIC
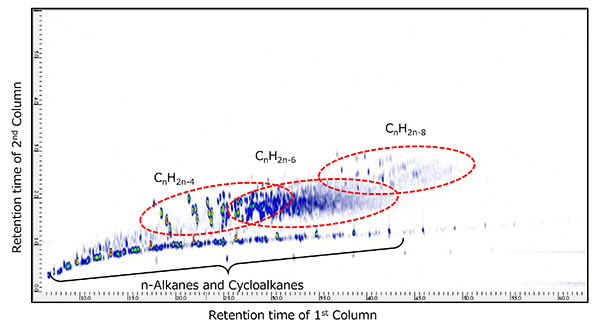
图8 原油馏分A的GC×GC/PI二维EIC
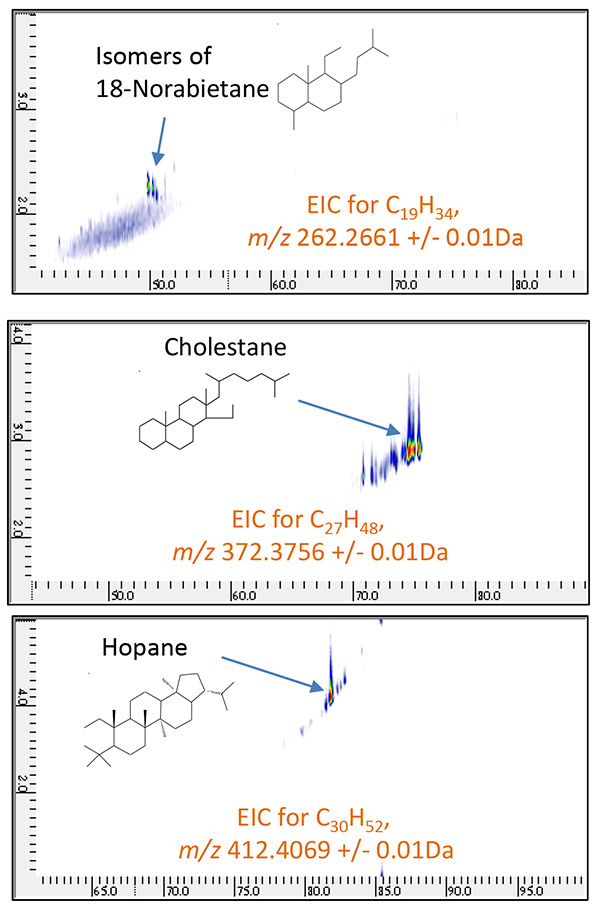
( m/z 262.2661, 372.3756, 412.4069 )
图9 原油馏分B的GC×GC/PI二维EIC
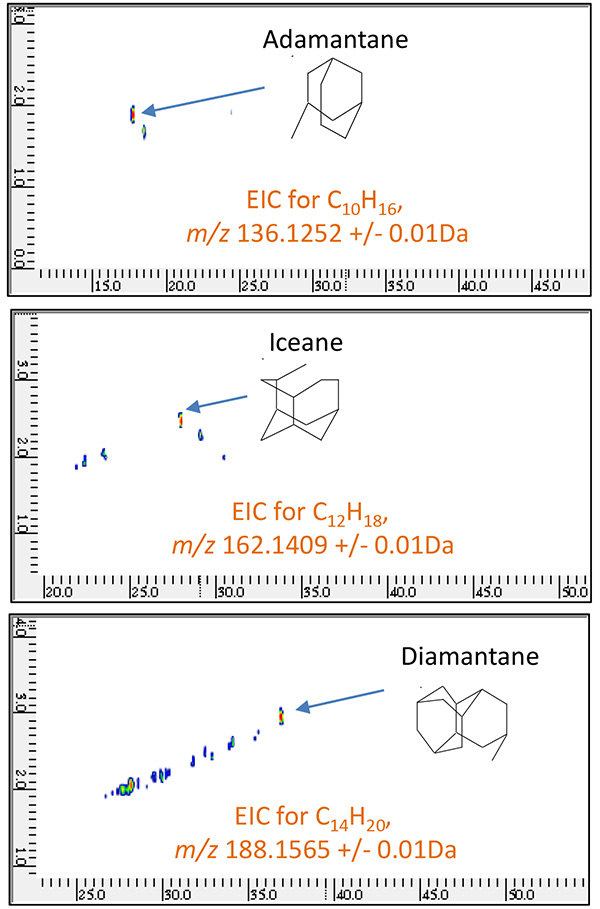
( m/z 136.1252, 162.1409, 188.1565 )
图10 原油馏分A的GC×GC/PI联合二维EIC
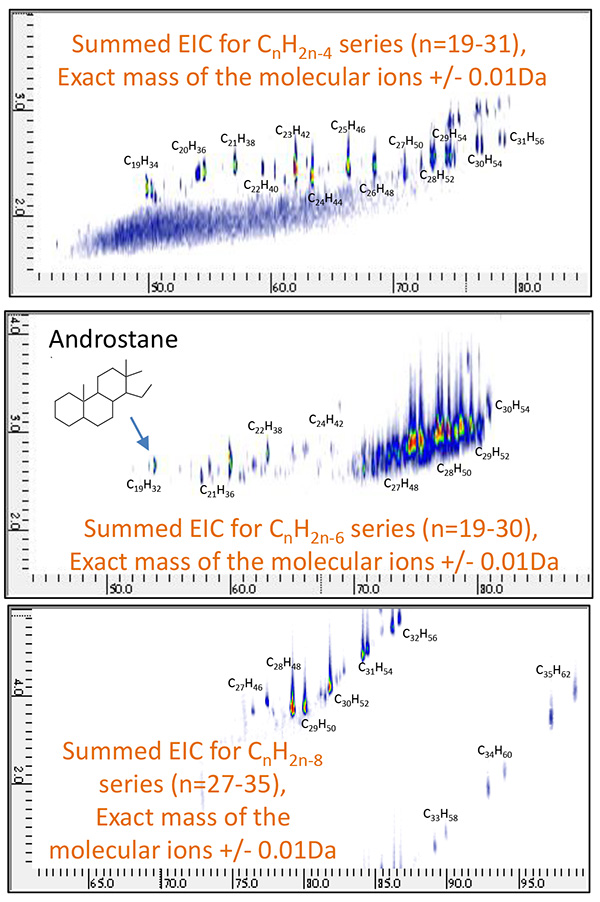
(CnH2n-4:n=19~31,CnH2n-6:n=19~31,CnH2n-8: n=27~35 )
图11 原油馏分B的GC×GC/PI联合二维EIC
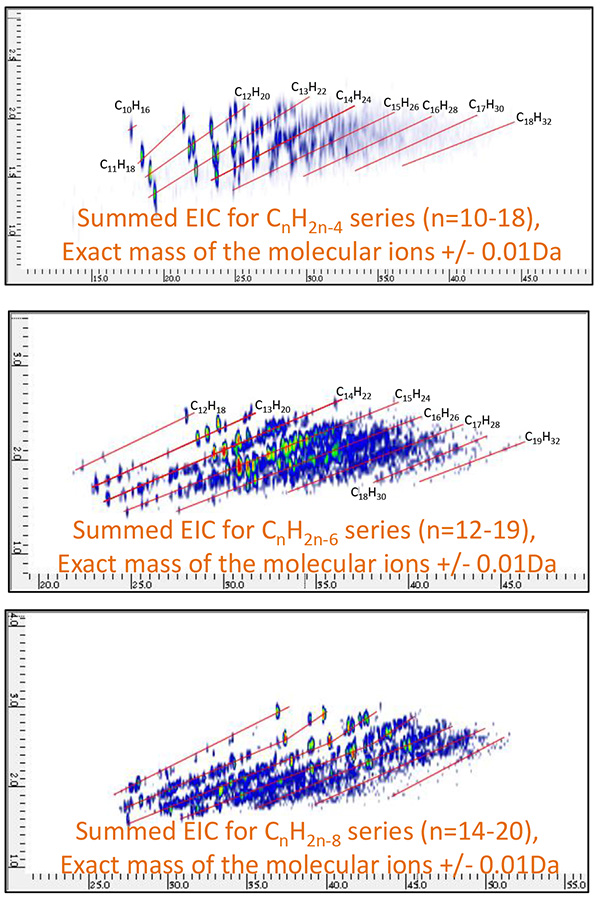
(CnH2n-4:n=10~18,CnH2n-6:n=12~19,CnH2n-8: n=14~20 )
表 2 代表性生物标志物及其分子离子m/z
| 化合物 | 有理式 | m/z |
|---|---|---|
| 18-降拉维烷 | C19H34 | 262.2661 |
| 胆甾烷 | C27H48 | 373.3756 |
| 藿烷 | C30H52 | 412.4069 |
| 金刚烷 | C10H16 | 136.1252 |
| 冰岛 | C12H18 | 162.1409 |
| 金刚烷 | C14H20 | 188.1565 |
摘要
GC×GC是一种先进的气相色谱技术,其色谱分离能力可以说大幅高于常规气相色谱分离。然而,为了最大限度地提高 GC x GC 的分离和分析能力,可以使用能够以高质量分辨率高速收集质谱的 TOFMS 以及从多个角度获取质谱的方法,具体而言,结合硬电离和软电离方法的分析。因此,GC x GC-PI-TOFMS 系统结合了 GC x GC(可检测碳氢化合物分子离子的 PI 离子源)和 AccuTOF™ GC 系列(可高速获取高分辨率质谱),可以说是分析石油样品中生物标志物等复杂混合物的极其强大的工具。
参考文献
- Z。刘,JB菲利普斯,J。色谱仪科学, 29 227(1991).
- J。 C吉丁斯,肛门。化学, 561258A(1984)。
- Gestel Co, Ltd、Nobuo Ochiai,“通过 GC×GC-TOFMS 进行环境污染物的超痕量分析”,JEOL MS 用户会议(2008 年)。
- S。桥本、Y Takazawa、A Fushimi、H Ito、K Tanabe、Y shibata、M Ubukata、A Kusai、K Tanaka、H Otsuka、K Anezaki、J。色谱仪A、 1178 187(2008).
- 九州环境管理协会,Morio Ueda,“使用 GC×GC-HRTOFMS 定性和定量测定燃料油中的有机化合物”,JEOL MS 用户会议(2010 年)。
- 日本电子新闻,卷。 44(2017),第 40-49 页。
- Anupam Giri 等人,肛门。化学, 89(10) (2017),p5395-5403。
