天游线路检测中心 冷冻电子显微镜技术发展及其对生命科学的贡献
JEOL 新闻第 50 卷第 1 期 难波圭一、加藤隆之大阪大学前沿生物科学研究生院
生物分子的三维结构信息不仅是生命科学的基础信息,也是医学药物发现的基础信息,近年来,除了传统的X射线晶体学和核磁共振方法之外,冷冻电子显微镜也引起了人们的关注。如何以高分辨率记录容易被电子束照射损坏的生物分子的图像,以及如何通过图像分析来分析原子级的三维结构?我们将介绍我们在冷冻电子显微镜方面独特技术发展的历史和现状,以及我们基于进一步技术发展对未来的期望和展望。
简介
2017 年诺贝尔化学奖授予 Jacques Dubochet(瑞士洛桑大学)、Joachim Frank(美国哥伦比亚大学)和 Richard Henderson(英国 MRC 分子生物学研究所),他们率先使用冷冻电子显微镜对生物分子进行三维结构分析。生物分子的三维结构信息是基础信息,不仅对生命科学而且对医学药物发现都很重要。近年来,除了传统的X射线晶体学和核磁共振方法外,冷冻电子显微镜也取得了显着的进展,确立了其作为结构分析方法的基础技术之一的地位。该奖项是为了表彰他作为这项技术创始人的贡献,该技术作为一种可以用非常小的水溶液样品实现原子级分辨率的结构分析方法而受到关注。在这里,我们向大家介绍一下我们自主研发的冷冻电镜技术的创新成果、由此带来的技术进步以及未来进一步技术发展的潜力。
利用冷冻电子显微镜的生物分子3D结构分析方法
支持各种生物体生命活动的各种机制,从细菌和酵母等单细胞微生物,到动物和植物等多细胞生物,甚至具有较高大脑功能的人类,都出奇地普遍。这是因为所有这些功能都是基于由构成蛋白质、核酸等的数千到数万个原子的空间构型决定的分子结构。而且,其三维结构是柔软的和动态的,并且被设计为可以主动利用热波动的动态结构。生命科学的主要挑战之一是阐明表达这些功能的机制,为此,有必要阐明数十万至数百万种各种生物分子的三维结构。冷冻电镜尤其是单颗粒图像分析的特点是不需要X射线晶体结构分析所必需的样品结晶,而且样品的分子量没有上限,这限制了NMR方法的应用。然而,在生物分子中,维持其三维结构的原子间键大多是氢键、离子键等非共价键,因此比金属、半导体等样品更容易受到电子束辐射损伤。为了最大限度地减少损伤并记录高图像质量的高分辨率分子图像,需要将生物分子的水溶液快速冻结为薄膜,将其嵌入非晶冰薄膜中,然后在用液氦或液氮冷却的样品台上保持低温的同时用电子束照射,以记录电子显微镜图像。事实上,在原子水平上可以照射而不造成损伤的电子束量为20至30 e-/Å2结果,由于物理统计噪声和朗道噪声(由单个入射电子检测信号水平的大分布引起的噪声),电子显微镜图像的图像质量变得极差。此外,由于每个分子图像都是以不同方向嵌入冰薄膜中的分子的投影图像,因此重建 3D 图像需要尽可能均匀地收集在各个方向上投影的尽可能多的图像。换句话说,必须通过有效收集尽可能多的分子图像并对齐按每个投影方向分类的分子图像的方向和位置以获得平均图像来降低噪声水平并显着提高信号水平。然后,通过确定每个平均图像的投影方向和反投影之间的相对关系,可以重建高分辨率的3D图像(图1)。为此,需要能够高效采集高质量电子显微图像的冷冻电子显微镜和图像探测器,以及高精度、高速的图像分析程序和高速计算机。下面我们将介绍我们为了解决这些问题而自行进行的设备开发的历史和成果。
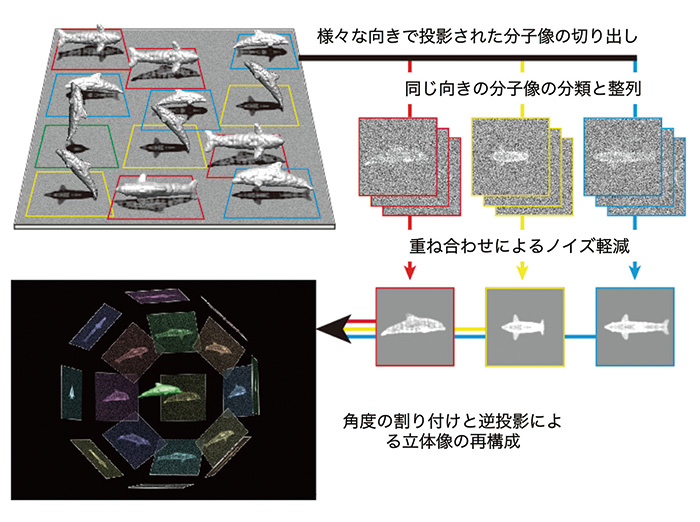
图。 1 单粒子图像分析方法示意图
这是通过将以不同方向嵌入冰中的生物分子建模为海豚,通过二维类平均图像,根据高噪声水平的电子显微镜图像的投影图像重建三维图像的过程的示意图。
冷冻电子显微镜、图像探测器以及图像数据收集和分析方法的演变
场发射电子枪
日本这一领域的先驱是藤吉义典博士(名古屋大学客座教授)。 20 世纪 80 年代,我们与 JEOL 共同开发了世界上第一个用液氦冷却的稳定样品台,从而可以通过最大限度地减少电子束照射造成的损坏来记录高质量的电子显微镜图像 [1]。我自己在1990年左右开始与Fujiyoshi博士合作研究,请他教我冷冻电镜,并采用冷冻电镜来分析细菌鞭毛纤维的结构,而之前的分析依赖于X射线纤维衍射和X射线晶体学。 1994年,松下电器工业株式会社在京阪奈科学城设立的基础技术研究所内联合成立了一个名为国际研究所的组织,并将肖特基型场发射电子枪(热FEG)引入了具有上述液氦冷却样品台的低温电子显微镜。即 JEM-3000SFF(天游线路检测中心 制造)(第 3 代:G3)[1]。 Fujiyoshi小组专注于膜蛋白的二维晶体结构,我们的目标是鞭毛纤维等超分子复合物的高分辨率三维结构分析(图2)。由于只能使用卤化银胶片作为图像探测器,采集高质量图像数据的效率较低,需要数年的长期数据采集和图像分析。不过,取得了许多令人瞩目的成果,到2000年代中期,以原子级分辨率分析膜蛋白二维晶体的三维结构和超分子结构已成为可能[2-5]。在鞭毛纤维中,我们从超过 40,000 个鞭毛蛋白分子的电子显微镜图像中获得了接近 4 Å 的分辨率,使得解析多肽主链和氨基酸侧链的折叠成为可能(图 3)[6]。

图。 2 难波集团冷冻电子显微镜的发展历史
红色的东西是新引入或开发的新的基本技术。
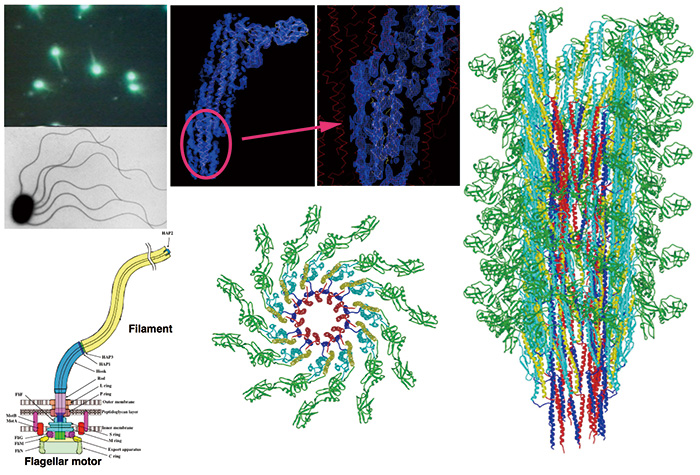
图。 3 驱动细菌游动的鞭毛纤维的冷冻电镜分子结构
利用 JEM-3000SFF 和卤化银胶片拍摄的电子显微镜图像的螺旋对称性进行结构分析。通过电子显微镜图像分析,首次解析了蛋白质分子中氨基酸的主链侧链,并构建了整个鞭毛纤维作为构成蛋白质鞭毛蛋白的巨大复合体的原子模型[6]。
CCD相机和Ω型能谱仪
2002年大阪大学前沿生物科学研究生院成立,我们的实验室搬到2004年竣工的吹田校区纳米生物学大楼时,JEM-3200FSC是一种电子显微镜系统,在文部科学省的追加预算下,将新的元素技术引入液氦冷却冷冻电子显微镜(图1)。 2)。这是理化学研究所播磨研究所藤吉博士推出的第四代(G4)[1]的改进版本。其中一项新的要素技术是安装在镜体内的改进的第二代Ω型能谱仪。由于薄冰膜的非弹性散射导致能量略有下降,电子束失去了相干性,对高分辨率电子显微图像没有贡献,并且背景噪声很高。然而,能谱仪表明它可以去除大部分非弹性散射电子,显着降低背景噪声,并将图像信噪比提高约两倍[7]。另一个是 4K x 4K CCD 摄像机 (TVIPS F415MP)。涂在一束玻璃纤维上的薄闪烁体层将电子束转换成光,由 CCD 检测并生成图像。虽然图像因数据层中电子束的散射而变得模糊,且分辨率本身不如胶片,但图像在拍摄后可以立即显示在桌面显示器上,并且还可以立即检查傅里叶变换图像,从而可以在短时间内确认和评估电子显微镜图像的图像质量和分辨率,这极大地促进了高质量电子显微镜图像的高效采集[7]。此外,通过停止从液氦罐向样品舱供应液氦,样品温度从4K的极低温度升高到50K左右,极大地提高了高质量图像数据的采集效率。在极低的温度下,可以将电子束照射造成的损伤降到最低,但由于样品的导电性极差,电子束照射对原本导电性较低的薄冰膜造成的充电,导致大多数拍摄的电子显微镜图像在一个方向上记录的分子图像模糊。导致可用于图像分析的高质量电子显微镜图像的良率不足百分之几。通过将样品温度提高到 50K 左右,这个问题得到了解决,几乎所有拍摄的电子显微镜图像现在都可以用于分析 [7]。这项技术进步使得以前需要数年时间的数据收集和图像分析时间缩短到大约1至2周。现在发现,细菌鞭毛钩、肌肉中的肌动蛋白纤维、细菌细胞分裂过程中分发质粒的ParM纤维、病原菌感染宿主细胞时使用的3型分泌器的针状纤维以及肌肉中肌球蛋白头紧密结合的肌动蛋白纤维等三维结构已被开发的。以 Å 分辨率进行逐个分析已成为可能 [7-12]。烟草花叶病毒外壳蛋白形成的堆叠盘获得了 38 Å 分辨率的结构(Fujii,未发表)。
侧入式氦冷却台
藤吉博士在20世纪80年代与JEOL共同开发的冷冻电子显微镜的液氦冷却样品台是顶入式且极其稳定的样品台,但由于它没有倾斜机构,因此无法进行电子断层扫描,需要采取特殊措施才能拍摄二维晶体的倾斜图像。因此,2003年,藤吉博士向科学技术协调基金申请了预算,开发配备倾斜机构的顶入式氦冷却样品台,我作为贡献者加入了该项目。这台带有倾斜机构的顶入式液氦冷却冷冻电子显微镜(第6代:G6)于2006年交付给京都大学和大阪大学(图2)[1]。使用这种显微镜,我们的目的是开发和建立一种使用电子束冷冻断层扫描观察生物超分子详细结构的方法。作为研究对象的旋转马达的细菌鞭毛基体通常通过用表面活性剂溶解细胞膜来分离和纯化,然后通过快速冷冻包埋在薄冰膜中,拍摄冷冻电镜图像,并使用单粒子图像分析来分析三维结构。然而,与基体弱结合的膜蛋白定子和鞭毛蛋白运输装置在分离和纯化过程中解离,使得无法观察功能结构。因此,我们利用这种带有倾斜机构的新型冷冻电子显微镜的电子束冷冻断层扫描方法,尝试快速冷冻细菌细胞本身并将其包埋在冰中,并详细观察仍然穿透细胞膜的鞭毛基体的结构。不幸的是,沙门氏菌的直径是 1μm,拍摄60度倾斜图像时,电子束穿过的样品厚度为2μm),使得使用加速电压为300 kV的电子束拍摄高分辨率倾斜图像变得困难,并且几年后随着小细胞样品的引入,跨膜基体的详细结构分析才成为可能[13]。为了进一步提高收集冷冻电镜图像数据以进行单颗粒图像分析的效率,2011年我们将这款冷冻电镜显微镜的样品台更改为JEOL独特的侧入式(第6代改进型:G6N),该型号易于用计算机控制,并且具有实现自动成像的潜力(图2)。该样品台的引入提高了分辨率和易用性,超出了我们的预期。为了确认冷冻电子显微镜的成像分辨率,必须使用非晶金属薄膜等测试样品,就像拍摄冰埋生物分子图像时应用大散焦来增强低分辨率图像的对比度一样。μm的大散焦条件下拍摄图像,并检查在傅里叶图像中可见的托恩环(见图4)延伸到什么分辨率。在安装完成当天进行的成像分辨率确认测试中,Pt/Ir薄膜样品的图像为1μ在m散焦拍摄的电子显微镜图像的傅立叶图像中,确认了Thon环延伸至超过20 Å分辨率的区域。为了使Thon环在这种散焦条件下延伸到高分辨率,需要用电子束平行照射样品,但样品台内置物镜的极片设计有电子光学系统,可以在用户不知情的情况下实现平行照射条件。但是,还有另一个问题。虽然这个样品台是液氦冷却,但冷却方式与顶入式不同,因此样品温度略高,为10至15 K。而且,与第4代不同的是,无法停止向样品舱供应液氦,将样品温度提高到50 K左右。而且,当时全球氦气供应受到限制,价格飞涨。在建造冷冻电镜设施时,大阪大学吹田校区的低温中心连接有氦气回收管道,虽然我们能够通过回收和液化氦气以低廉的价格供应氦气,但氦气回收管道的结构很容易让空气混入,给低温中心造成频繁的不便。因此,2012年左右,我们决定停止使用液氦。通过将液氮填充到显微镜主体内部的液氮罐和液氦罐来冷却样品,可以在将样品台温度稳定地保持在液氮温度77K下7至8小时的同时拍摄电子显微镜图像。利用TVIPS的CCD相机驱动软件系统,可以通过近乎自动的拍摄来有效地收集图像数据。
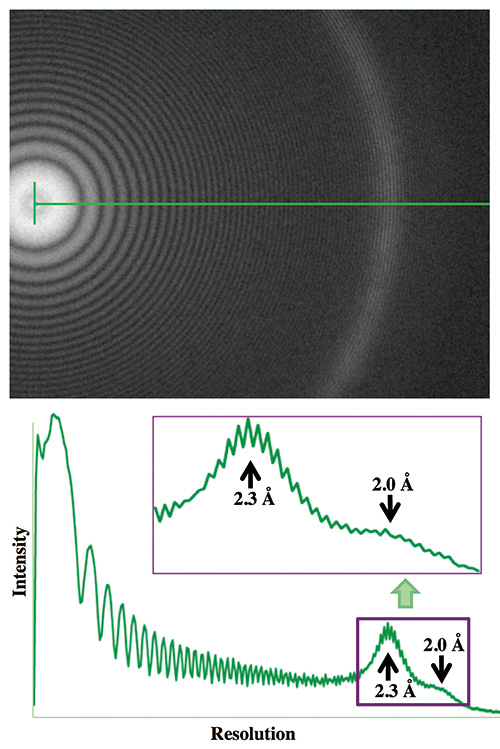
图。 4 使用 CRYO ARM™ 拍摄的 Pt/Ir 薄膜图像的托恩环和傅立叶图像轮廓
CRYO ARM™1 的 Pt/Ir 薄膜样品μ在 m 散焦拍摄的图像的傅立叶图像中,Thon 环的分辨率延伸至 18 Å。
电子束直接检测型CMOS相机
最后,在 2013 年,推出了电子束直接检测 CMOS 相机。几年前,加州大学旧金山分校的 David Agard 一直与 Gatan 合作开发用于 X 射线图像探测器的 CMOS 器件,该器件是由加州大学伯克利分校的一个小组开发的,用于电子显微镜。 Gatan于2013年使用该CMOS器件完成并开始销售电子显微镜图像检测器系统(Gatan K2 Summit)。其主要特点是即使直接暴露于300 kV加速的电子束也不会损坏,而且由于元件层很薄,电子束散射导致的图像模糊最小,并且可以以400帧/秒的速度捕获1600万像素的图像,像素数为4K x 4K。原本为20~30e-/Å2的低电子剂量拍摄的冷冻电镜图像中,如果将成像时间从几秒延长至约10秒,则可以对每一帧中入射到元件上的电子束的数量进行计数,从而可以检测每一帧中的单个电子。在CCD相机等能量存储型图像检测元件中,每个入射电子所存储的能量变化很大,这成为被称为朗道噪声的大噪声源。由于入射到每个像素的电子数量很少,因此它是不可忽视的统计噪声源,并且是低电子剂量拍摄的冷冻电镜图像中出现大噪声的原因。然而,单电子检测使得消除这种朗道噪声成为可能。加州大学旧金山分校的Yifan Cheng充分利用这套CMOS摄像系统的性能,分析了TRPV1(一种感知热和辣味的膜蛋白受体离子通道)的三维结构,并于2013年底发表了两篇论文自然[14, 15]。他们使用长期以来难以结晶的纯化膜蛋白样品的少量水溶液创建了冷冻样品网格,并分析了从约 1,000 张冷冻电镜图像中获取的约 100,000 张单粒子图像。他们获得了分辨率为 34 Å 的三维图像,并成功构建了分子模型。在该图像分析中,有效实现高分辨率的方法是通过集成数十个高速帧的单电子检测,以大约每秒5帧的速度将电子显微镜图像记录为运动图像,并通过校正样品网格的机械漂移引起的图像模糊和电子束照射引起的薄冰膜变形来锐化图像[16]。我们在2015年也能够安装这款CMOS相机Gatan K2 Summit,因此我们将其安装在上述侧入式冷冻电子显微镜(第6代改进型号:G6N)中,并尝试利用其作为图像检测器的高性能。上述视频模式使得获得包括膜蛋白在内的各种生物超分子的原子级分辨率成为可能,迄今为止达到的最高分辨率为27 Å,这是利用志贺氏菌3型毒力因子分泌针的管结构获得的(Fujii和Yamada,未发表)。然而,由于分辨率很大程度上取决于样品分子的结构稳定性和低温样品网格上薄冰膜的厚度,因此对于好的样品来说,应该可以实现 20 Å 以上的分辨率。
CRYO ARM™ 的开发
FEI(现为 Thermo Fisher Scientific)是一家美国电子显微镜制造商,自 20 世纪 90 年代末以来一直在开发易于生命科学研究人员使用的高性能冷冻电子显微镜,并于 2004 年开发并发布了 Polara,并于 2008 年开发并发布了 Titan Krios。特别是,Titan Krios 是一种通过将 12 个冷冻样品网格插入到杂志中来实现自动成像的系统,加载将它们放入自动样品网格交换器(autoloader)中,通过远程控制将每个网格插入镜体内的样品台中,确认其质量,并指定成像区域。该系统被高度评价为极其用户友好的冷冻电子显微镜系统,该系统需要收集大量电子显微镜数据,以便使用断层扫描对细胞内分子结构进行 3D 观察,并使用单粒子图像分析进行分子结构分析。JEOL于2009年开发了JEM-ARM200F(俗称ARM:原子分辨率显微镜)作为用于材料研究的高分辨率电子显微镜,在世界范围内获得了高度评价。基于该ARM,我们开发了充分利用其高分辨率电子光学系统性能的稳定且自动控制的冷冻电子显微镜载物台、比Titan Krios更方便的冷冻样品网格自动加载器以及自动液氮填充系统。通过将这些与Ω型能谱仪一起集成到ARM中,我们希望创造出超越Titan Krios的最先进的冷冻电子显微镜。正当其时,理化学研究所生物系统研究中心主任柳田俊雄博士(特聘教授、名誉教授、神经信息通信研究中心主任)2010年为筹备中心的设立而申请的尖端研究基础设施开发项目预算被采纳并分配为理化学研究所与大阪大学之间建立合作中心的预算,因此我们使用了该预算的一部分来要求JEOL开发基于 ARM 的高度自动化高分辨率冷冻电子显微镜。我们向 JEOL 的技术团队详细传达了我们的概念和所需性能,经过多次讨论后,设备开发继续进行。它的昵称是 CRYO ARM™(图 2)。目标是实现超过 20 Å 的分辨率。由于各种原因,设备开发被推迟,但原型机 CRYO ARM™ 已于 2016 年 5 月交付并安装在前沿生物科学研究生院纳米生物学大楼的冷冻电镜设施中。在最初概念时,基础 ARM 只是加速电压为 200 kV 的热 FEG,因此该原型机也具有相同的规格。测试样品的 Pt/Ir 薄膜图像 1μm 在m散焦拍摄的电子显微镜图像的傅立叶图像中,确认了Thon环延伸至超过18 Å分辨率的区域(图4)。我们的重要作用是创建各种生物分子的冷冻样品网格并使用 CRYO。使用 ARM™ 拍摄图像,使用单粒子图像分析重建三维图像,并根据其分辨率评估设备的性能。此外,还从各个方面进行了详细评估,包括作为冷冻电子显微镜的设备和控制软件的可用性、自动成像数据收集的效率以及全自动成像的自动成像软件的改进。我们努力向 JEOL 的技术团队提供反馈,并提供尽可能多的信息以改进系统。正如预期的那样,在安装后的大约六个月内,机械故障频繁发生,主要是在自动装载机和用于准备插入样品网格的低温工作站的操作中。为了解决这个问题,JEOL 的工程师几乎每周都会从昭岛赶来,并努力提出各种想法,例如改变零件的材料和设计以及调整传感器和执行器的位置。样品台的设计也发生了显着变化,并且改进了显微镜系统的控制软件,包括引入了电光系统控制软件,只需按一下按钮即可实现平行照射条件和无框成像条件,以及改进了机械系统控制软件。冷冻电子显微镜基于多年来积累的各种专业知识。只有当所有这些都完美实现时,冷冻电子显微镜系统才是完整的。这台样机于2017年2月开始稳定运行,此后没有出现任何机械问题。我们用它作为生物分子的测试样本β我们尝试使用半乳糖苷酶重建高分辨率 3D 图像。在改进CRYO ARM™硬件和软件的同时,我们不断评估和改进JEOL提供的自动拍摄软件JADAS的可用性和操作稳定性。β我们反复收集和分析半乳糖苷酶单颗粒图像数据,2017年夏天,我们在大约3天的自动数据收集过程中捕获了大约2,500张电子显微镜图像,并从我们采集的大约350,000张单颗粒图像中选择了88,000张高质量图像,重建的3D图像的分辨率为26 Å(图1)。 5)(加藤,EMDB 注册)ID:6840)。JEOL 于 2017 年 6 月发布了 CRYO ARM™ 的产品版本,并根据加速电压将其命名为 CRYO ARM™ 200 和 CRYO ARM™ 300。两者均标配冷场发射电子枪(Cold FEG)和无孔相位板。无孔相板对于分子量为 150 kDa 或更小的相对较小的生物分子的结构分析非常有效。与肖特基型相比,冷FEG的能量色散减半,并且由于电子束极高的相干性,高分辨率图像信号大大增强。事实上,在比较 Pt/Ir 薄膜的散焦图像时,差异很明显:Thon 环在 200 kV 热 FEG 中保持在 18 Å 左右,而在 300 kV 冷 FEG 中扩展到 11 Å 左右。换句话说,如果我们能够开发并整合一个能够利用这种高分辨率的超稳定冷冻样品台,那么水性生物分子样品结构分析中 1 Å 分辨率的梦想可能会成为现实(图 6)。通过改进并行处理图像数据收集和分析的管道软件,以及确定过程中分析结果质量的人工智能软件,可以显着提高结构分析的吞吐量。目前正在与 JEOL 进行联合技术开发,以解决这些技术问题。
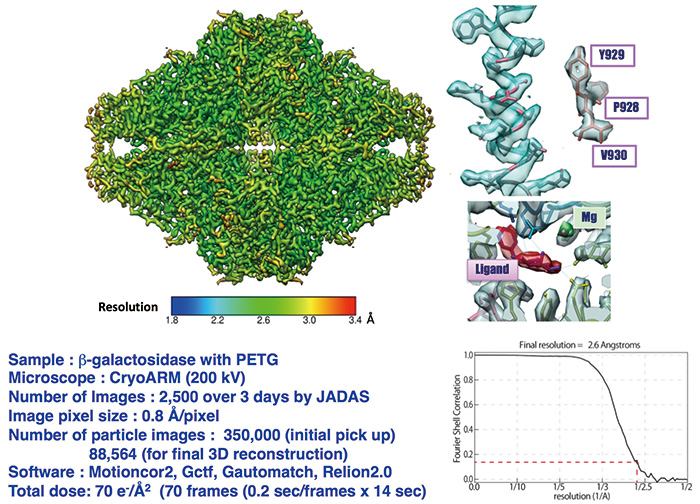
图。 5 使用 CRYO ARM™ 获得 26 Å 分辨率的 β-半乳糖苷酶结构
整个分子结构的平均分辨率为26 Å,但局部分辨率并不均匀,当以彩虹色显示时,有分辨率接近2 Å的地方,并且Tyr929的六元环密度中可见空洞。
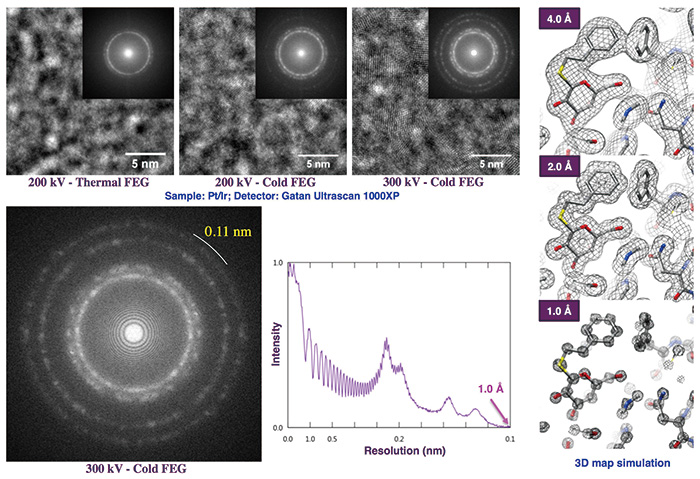
图。图6 Cold FEG和各分辨率3D图对高分辨率图像信号的增强效果
电子显微镜图像样本为 Pt/Ir 薄膜约 1μ使用 m 散焦拍摄的照片。右图中的模拟显示,目前冷冻电镜图像的平均分辨率可以以 4 Å 分辨率解析氨基酸侧链的形状,以 1 Å 分辨率解析单个原子。数据由 JEOL 的 Hirofumi Iijima、Takeshi Kaneko、Sohei Motoki、Isamu Ishikawa 和 Yoshihiro Ozo 提供。
结论(总结、结论)
生命的各种功能和机制都是由生物分子的动态相互作用网络决定的,因此有必要阐明在原子水平上反复解离和缔合的生物分子复合物的详细结构,以阐明生命功能。冷冻电子显微镜越来越有可能看到无数的分子结构和分子间相互作用,而以前由于结晶的必要性和分子量的上限而无法看到这些。冷冻电子显微镜在生命科学、医学和医学药物发现的未来发展中将发挥不可估量的作用。可以毫不夸张地说,进一步推动冷冻电镜相关技术的发展,使其成为能够充分发挥这一重要作用的技术,是人类社会面临的最重要的挑战之一。
致谢
我要向从 20 世纪 90 年代初开始冷冻电子显微镜技术开发和应用以来一直对我表示感谢的藤吉义德博士以及 JEOL 的技术团队、管理团队、总部和大阪分公司表示深深的谢意。
参考文献
- 藤吉芳典:日本电子新闻41, 13-21 (2009).
- Kimura Y、Vassylyev DG、Miyazawa A、Kidera A、Matsushima M、Mitsuoka K、Murata K、Hirai T、Fujiyoshi Y:自然 389, 206-211 (1997).
- Murata K、Mitsuoka K、Hirai T、Walz T、Agre P、Heymann JB、Engel A、Fujiyoshi Y:自然 407, 599-605 (2000).
- 宫泽 A、藤吉 Y、安温 N:自然 423, 949-955 (2003).
- Gonen T、Cheng Y、Sliz P、Hiroaki Y、Fujiyoshi Y、Harrison SC、Walz T:自然 438, 633-638 (2005).
- 米仓 K、米仓 Maki-米仓 S、难波 K:自然 424, 643-650 (2003).
- 藤井 T、加藤 T、难波 K:结构 17, 1485-1493 (2009).
- Fujii T、Iwane AH、柳田 T、难波 K:自然 46, 724-8 (2010).
- Gayathri P、Fujii T、Møller-Jensen J、van den Ent F、Namba K、Löwe J:科学 338, 1334-1337 (2012).
- Fujii T、Cheung M、Blanco A、Kato T、Blocker AJ、Namba K:过程。国家。阿卡德。科学。美国 109, 4461-4466 (2012).
- 藤井 T、难波 K:自然交流 8, 13969 (2017).
- 藤井 T、加藤 T、平冈 KD、宫田 T、南野 T、Chevance FF、休斯 KT、难波 K:自然交流 8, 14276 (2017).
- 川本 A、森本 YV、宫田 T、南野 T、休斯 KT、加藤 T、难波 K:科学。代表 3, 3369 (2013).
- 廖敏、曹娥、朱利叶斯·D、程宇:自然 504, 107-112 (2013).
- 曹锷、廖明、程宇、朱利叶斯·D:自然 504, 113-118 (2013).
- 李 X、穆尼 P、郑 S、布斯 CR、布劳恩菲尔德 MB、古本斯 S、阿加德 DA、程 Y:自然方法 10, 584-590 (2013).
